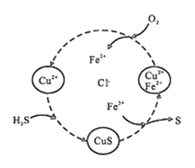
 下列说法错误的是( )
下列说法错误的是( )


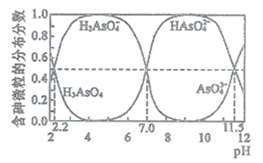

滤液3经过多次萃取与反萃取制备CoCl2晶体。

已知:
①焦亚硫酸钠Na2S2O5 , 常做食品抗氧化剂。MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
| Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mg2+ | |
| 开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 9.6 |
| 完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 11.1 |
请回答:
①230℃,向容器中充人0.5 mol CO2和1.5molH2 , 当H2转化率达80%时放热19.6kJ,写出该反应的热化学方程式。
②一定条件下,往2L恒容密闭容器中充人1.0 mol CO2和3.0molH2 , 在不同催化剂作用下,CO2的转化率随温度的变化如右图所示,催化效果最佳的催化剂是。(填催化剂“I”、“II”或“III”)。b点v(正)v(逆)(填“>”、“<”或“=”)。此反应a点已达到平衡状态CO2的转化率比c点高的原因是。


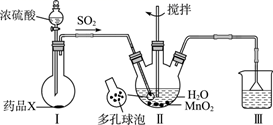
A.高锰酸钾溶液B.浓硫酸C.氢氧化钠溶液D.饱和碳酸氢钠溶液
为检验该气体已完全除去,C中盛放的试剂为。(填试剂名称)。



②图2为铜的某种氯化物晶胞示意图,该物质的化学式是。原子坐标参数可表示晶胞内部各原子的相对位置,上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为。
③图示晶胞中C、D两原子核间距为298 pm,阿伏加德罗常数的值为NA , 则该晶体密度为 g▪cm-3(列出计算式即可)。

①遇FeCl3溶液显紫色
②苯环上的一氯取代物只有两种