 B .
B .  D .
D . 
 D . 木精:CH3OH
D . 木精:CH3OH
 C . 乙醛的结构简式:CH3COH
D . 2-甲基戊烷的键线式
C . 乙醛的结构简式:CH3COH
D . 2-甲基戊烷的键线式  B .
B .  C .
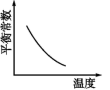
C . 6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l);ΔH1
2 H2(g)+ O2(g)= 2H2O(g);ΔH2
C(s)+ O2(g)=CO2(g);ΔH3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的ΔH为( )
 的说法不正确的是( )
的说法不正确的是( )


![]()
![]()



 B .
B . 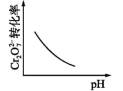 C .
C .  D .
D . 
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热,冷却后,取少量溶液,加入AgNO3溶液 | 若有沉淀产生,则CH3CH2Br发生水解 |
| B | 比较Br2和I2的氧化性强弱 | 将少量溴水加入KI溶液中,再加入CCl4 , 振荡,静置 | 若下层液体呈紫红色,则Br2的氧化性强于I2 |
| C | 检验Fe(NO3)2晶体是否氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 若溶液变红,则Fe(NO3)2晶体已氧化变质 |
| D | 比较HNO2和CH3COOH电离出H+的能力 | 用pH试纸分别测CH3COONa溶液和NaNO2溶液的pH | 若CH3COONa溶液的pH比NaNO2溶液的pH大,则HNO2电离出H+的能力比CH3COOH的强 |
已知发生的反应为: ,
,
表示CO2的平衡压强,
,
,
天然雨水的pH<7,用电离方程式解释其原因。
:。
反应1(甲醇合成):
反应2(甲醇脱水):
反应3(逆水汽变换):
相关物质变化的焓变示意图如下:
| | |
| | |
| | |
| |
双功能催化剂通常由甲醇合成活性中心和甲醇脱水活性中心组成。在一定条件下,将CO2与H2以1:3体积比通过双功能催化剂,测定含碳产物的物质的量分数随时间变化如图1所示。

写出反应3的热化学方程式。
 )是一种新型生物降解材料,可用于包装食品。某化学兴趣小组利用化学解聚方法,由废旧聚乳酸餐盒制得高纯乳酸钙。
)是一种新型生物降解材料,可用于包装食品。某化学兴趣小组利用化学解聚方法,由废旧聚乳酸餐盒制得高纯乳酸钙。 已知:乳酸是淡黄色黏性液体,与乙醇、水混溶;乳酸钙是白色粉末,溶于冷水,易溶于热水,不溶于乙醇、丙酮等有机溶剂。

I.废旧聚乳酸材料的解聚
①分别取一定量的NaOH固体、无水乙醇和白色聚乳酸餐盒碎片,装入锥形瓶,加热解聚(装置如右图所示);
②待反应完毕,冰水浴冷却,向锥形瓶中加入一定量浓盐酸,然后加热浓缩,得到淡黄色黏稠状液体和少量白色不溶物;
③往②中所得混合物加入20 mL无水乙醇并操拌均匀,静置、抽滤、洗涤,弃去白色不溶物。
II.乳酸钙的制备……
请回答:
a.加入盐酸; b.加入丙酮; c.趁热过滤并取滤液;
d.过滤并收集沉淀物;e.冰水浴下剧烈搅拌。
利用pH试纸“控制溶液的pH约为7”的操作方法是。
①分子中有4种不同化学环境的氢原子;
②分子中含有苯环、甲氧基(-OCH3),没有羟基、过氧键(-O-O-)。