

|
A |
B |
C |
D |
|
|
|
|
|
|
制备SO2 |
制备CuCl |
干燥CuCl |
吸收SO2尾气 |



已知:浸出液中的阳离子主要为Sb3+、Fe3+、Fe2+。
下列说法错误的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 乙醇钠的水溶液显强碱性 | C2H5O-结合H+的能力强 |
| B | 向KBrO3溶液中通入少量Cl2 , 然后再加入少量苯,有机层呈橙红色 | 氧化性:Cl2>Br2 |
| C | 向盛有KI3溶液的两支试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | 溶液中存在平衡: |
| D | 向等体积等浓度的稀硫酸中分别加入少许等物质的量的ZnS和CuS固体,ZnS溶解而CuS不溶解 | Ksp(CuS)<Ksp(ZnS) |

 下列说法正确的是( )
下列说法正确的是( )

 已知:“浸取”时PbO转化为Na2PbO2。
已知:“浸取”时PbO转化为Na2PbO2。
回答下列问题:
②结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是。
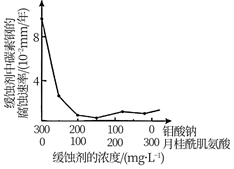
①若缓蚀剂钼酸钠-月桂酰肌氨酸的总浓度为300 mg/L,则缓蚀效果最好时钼酸钠( M=206 g/ mol)的物质的量浓度为mol/L(保留3位有效数字)。
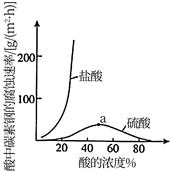
②a点前,随着酸的浓度增大,碳素钢在盐酸中的腐蚀速率明显比在硫酸中腐蚀速率快,其原因可能是,请设计实验证明上述结论。
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) △H2=-1269.0 kJ/mol
若4NH3(g) +6NO(g) 5N2(g) +6H2O(g)的正反应活化能为E正 kJ/mol,则其逆反应活化能为kJ/mol(用含E正的代数式表示)。

①工业上应选择催化剂(填“甲”或“乙”)。
②M点是否为对应温度下NO的平衡转化率,判断理由是。温度高于210℃时,NO转化率降低的可能原因是。

①ab两点体系总压强pa与pb的比值 =;同一温度下图象呈线性变化的理由是。
②温度为T2时化学平衡常数Kp=,T1T2(填“>”、“<”或“=”)。
回答下列问题:
①1 mol [ ZrCl4( H2NCH2CH2NH2)]中含有σ键的物质的量为mol。
②H2NCH2CH2NH2形成[ ZrCl4( H2NCH2CH2NH2)]后,H-N-H键角将(填“变大”、“变小”或“不变”),原因是。

①TiO2晶胞中O2-的配位数是。
②TiO2晶胞中A、B的原子坐标为(0.69,0.69,1),(0.19,0.81,0.5),则C、D原子坐标为、。
③已知二氧化锆晶胞的密度为ρ g·cm-3 , 则晶体中Zr原子和O原子之间的最短距离pm(列出表达式,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/mol)。

已知:+4价钒的化合物易被氧化。
回答下列问题:
称量a g产品于锥形瓶中,用20
mL蒸馏水与30 mL稀硫酸溶解后,加入0.02mol/LKMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2 , 最后用c
mol/L (NH4)2Fe( SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知:
+Fe2++2H+= VO2++Fe3++H2O)
①NaNO2溶液的作用是。
②粗产品中钒的质量分数表达式为(以VO2计)。
③若(NH4)2Fe( SO4)2标准溶液部分变质,会使测定结果 ( 填“偏高"、“偏低”或“无影响")。
 为原料制备
为原料制备  的合成路线(其他试剂任选) 。
的合成路线(其他试剂任选) 。