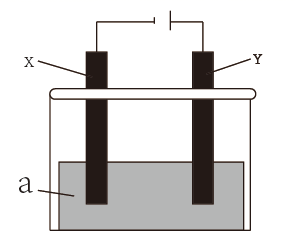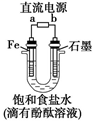
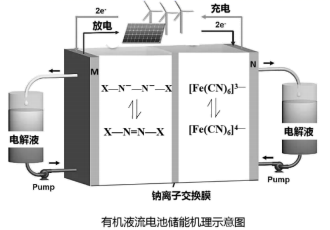
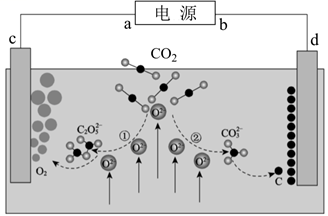


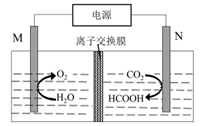

下列叙述错误的是( )
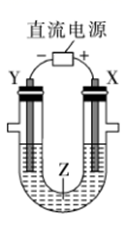
在保证电极反应不变的情况下,不能替代 Cu 作电极的是 (填字母序号)。
电解过程中,X 极区溶液的 pH(填“增大”“减小”或“不变”)。

已知:①矿粉的主要成分是 、ZnS,还含有少量FeS、CuS、
等。
②酸浸时反应之一: 。该生产过程中,
与
不反应。
③ 的氧化性与溶液pH有关。
请回答:
称取一定质量的铁钉,放入烧杯中→()→()→()→()→()
a.加过量浓硫酸
b.加过量稀硫酸
c.置于坩埚中,小火烘干
d.置于石棉网上,小火烘干
e.取出,用蒸馏水洗涤
f.搅拌,至气泡速率突然减小
g.用电子天平称量
h.用托盘天平称量
①下列关于实验过程的说法,正确的是(填字母)。
A.先在滤纸上称量好 粉末,再倒入锥形瓶
B.配制 溶液时宜在棕色容量瓶中进行
C.“振荡至充分反应”时,锥形瓶须加塞密封
D.滴定时的指示剂是
E.滴定终点后仰视读数,会导致 纯度偏大
②读取滴定管中 溶液的示数时,因溶液颜色的干扰,凹液面最低点无法准确定位,此时可改为读取处的示数。
①铅蓄电池总的化学方程式为: ,使用(放电)段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用;
②镍镉碱性充电电池放电时,正极反应为: ,负极反应式:
,使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用;
回答下列问题:
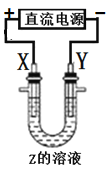
①若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阴极只析出6.4g固体,则需要加入(填化学式)即可恢复电解质溶液的浓度。
②可用该装置在实验室模拟铝制品表面“钝化”处理,可使铝制品表面形成较致密的氧化膜以更好地保护铝制品,a是稀硫酸溶液,写出Y电极上发生的电极反应式。