①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
 下列反应中符合上述全部图象的是( )
下列反应中符合上述全部图象的是( )
①H2(g)+ O2(g)═H2O(l) △H=﹣285.8kJ•mol﹣1
②H2(g)+ O2(g)═H2O(g) △H=﹣241.8kJ•mol﹣1
③C(s)+ O2(g)═CO(g) △H=﹣110.5kJ•mol﹣1
④CO2(g)═C(s)+O2(g) △H=+393.5kJ•mol﹣1
回答下列各问题:
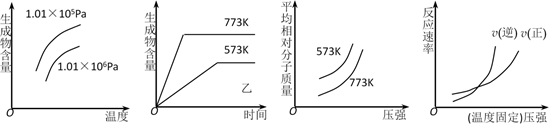
①用“>”、“=”或“<”填空:该反应的 Δ H0,m+np。
②用“增大”“减小”或“不变”填空(其他条件不变):恒容下加入 B,则 A 的转化率;升高温度,则平衡时 B、C 的浓度之比 c(B)/c(C)将;加入催化剂,平衡时气体混合物的总物质的量。
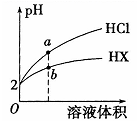
①该温度时水的离子积常数 Kw=。
②该温度下,将 pH=3 的 H2SO4 溶液与 pH=11 的 NaOH 溶液按等体积混合,所得混合溶液的 pH 为。
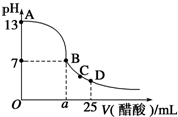
①该氢氧化钠溶液浓度为。
②在 B 点,溶液中离子浓度大小关系为。
③在 D 点,c(CH3COO-) c(Na+) (填“<”“>”或“=”)。
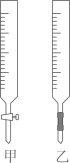
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸 25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作 2-3 次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准 NaOH 溶液润洗后,将标准液注入碱式滴定管“0”刻度以上 2-3cm 处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
|
滴定次数 |
待测液体积/mL |
标准溶液的体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
0.60 |
20.60 |
|
3 |
25.00 |
0.20 |
20.19 |
计算该盐酸的物质的量浓度为(保留 4 位有效数字)。