| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10−16 | 2.2×10−20 | 4.0×10−38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )

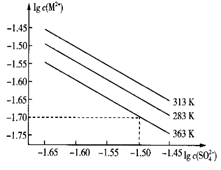
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
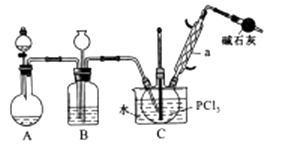
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液 40.00 mL,使 Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(填标号),滴定终点的现象为。
a.FeCl2
b.NH4Fe(SO4)2
c.淀粉
d.甲基橙
②Cl元素的质量百分含量为(列出算式)。
③步骤III加入硝基苯的目的是,如无此操作,所测Cl元素含量将会(填“偏大”“偏小”或“不变”)。


②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。

请结合以上信息,判断工业脱硫应选择的最佳pH范围,并说明原因:。

①该过程的热化学方程式是。
②比较压强p1和p2的大小关系:p1 p2(选填“>”“<”或“=”)。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程示意图如下。

①吸收池中发生反应的离子方程式是 。
②结合电极反应式,简述K2CO3溶液的再生原理:。
 已知:25℃时相关物质的Ksp见下表
已知:25℃时相关物质的Ksp见下表
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 |
回答下列问题:
|
化学式 |
HA(A代表某种酸根) |
HNO2 |
H2CO3 |
|
Ka |
Ka=4.9´10-10 |
Ka=4.6´10-4 |
Ka1=4.1´10-7 Ka2=5.6´10-11 |

①充分反应后a试管中大量存在的离子是。
②用离子方程式表示b试管中发生的反应。