| 实验 | 现象 | 结论 | |
| A | 向0.1mol/L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比 后者的大 | 碳酸的酸性强于亚硫酸 |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液 | 溶液中有白色沉淀 | 溶液中含有SO |
| D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN⇌Fe(SCN)3+3KCl平衡向逆反应方向移动 |
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
A.KMnO4 B.H2O2 C.氯水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3 , 可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
①可选用作滴定指示剂,滴定终点的现象是。
②CuCl2溶液与KI反应的离子方程式为。
③该试样中CuCl2·2H2O的质量百分数为。
|
化学式 |
电离平衡常数 |
|
HCN |
K=4.9×10-10 |
|
CH3COOH |
K=1.8×10-5 |
|
H2CO3 |
K1=4.4×10-7 , K2=4.7×10-11 |
|
实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
反应后溶液pH |
|
a |
0.1 |
0.1 |
pH=8 |
|
b |
c |
0.2 |
pH=7 |
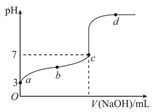
①从a组情况分析,HA是强酸还是弱酸。
②b组情况表明,c0.2(选填“大于”、“小于”或“等于”)。该混合液中离子浓度c(A-)c(Na+)(选填“大于”、“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c(OH-)=mol/L。写出该混合溶液中下列算式的精确结果。c(Na+)-c(A-)=mol/L。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
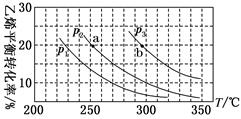
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1K2(填“<”、“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2
B.v(N2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正v(N2)逆(填“<”、“>”或“=”)。
①该反应的平衡常数表达式为K=。
②下列各项中,不能够说明该反应已达到平衡的是(填序号).
A.2v正(H2)=v逆(CO)
B.一定条件下,单位时间内消耗2molH2 , 同时生成1molCH3OH
C.恒温、恒容时,容器内的压强不再发生
D.恒温、恒容时,容器内混合气体的密度不再变化
E.混合气体的平均相对分子质量不随时间而变化
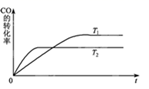
①该反应的ΔH0(填“<”、“>”或“=”)。
②T1和T2温度下的平衡常数:K1K2(填“<”、“>”或“=”)。
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式。
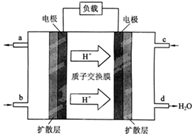
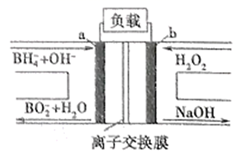
①该电池工作时,b口通入的物质为
②该电池负极的电极反应式为