 D .
D . 
| 实验序号 | 实验装置 | 试剂X | 实验现象 |
| ① | | 酸性 | 溶液由无色变为绿色 |
| ② | 稀硫酸 | 无明显现象 | |
| ③ | | 出现白色浑浊 | |
| ④ | 酚酞试液 | 溶液由无色变为红色 |
由上述实验现象不能得出的结论是( )


| 选项 | 实验操作和现象 | 结论 |
| A | 将燃着的镁条迅速伸入集满CO2的集气瓶,剧烈反应,发光发热,瓶内产生大量白烟,瓶壁上有黑色颗粒 | CO2在一定条件下能支持燃烧 |
| B | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 将少量铁粉、5mL苯和1mL液溴混合后产生的气体通入AgNO3溶液中,产生淡黄色沉淀 | 苯和液溴发生了取代反应 |
Ⅰ.
Ⅱ.
催化反应相同时间,测得不同温度下 的转化率如图1所示(图中虚线表示相同条件下
的平衡转化率随温度的变化),
的产率如图2所示。

下列有关说法正确的是( )
①该反应的离子方程式为;
②当溶液 时,该溶液中主要存在的阴离子有(填化学式);
③25℃时,反应 的平衡常数K=(填数值)。
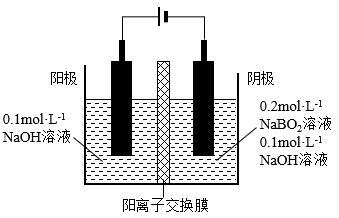
①电解池阴极的电极反应式为。
②两电极区间使用阳离子交换膜,不允许阴离子通过的原因是。
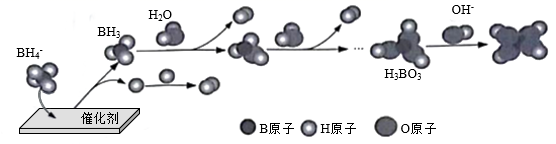
①其他条件不变时,以 代替
催化释氢,所得气体的分子式为。
②已知: 为一元弱酸,
水溶液呈酸性的原因是(用离子方式表示)。

①0~20min内,温度随时间快速升高的原因是。
②20min后,氢气体积在增加,而温度却下降的原因是。

①有一个六元环,该六元环含一个О原子和一个N原子。
②能发生银镜反应。
③核磁共振氢谱有四组峰,峰面积之比为6∶4∶2∶1。

①设计A→B步骤的目的是。
②写出以 ![]() 和
和 ![]() 为原料制备
为原料制备  的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
①将0.200 气样通入酸化的
溶液中,使
完全被氧化为
;(气样中的其它气体不参与反应),加水稀释至100.00mL;
②微热,除去过量的 ;
③量取20.00mL该溶液,加入20.00mL
溶液,充分反应;
④用 溶液滴定剩余的
,终点时消耗
溶液20.00mL,
已知: (未配平);
(未配平)
反应装置如图所示(夹持仪器已略去)。先向三颈烧瓶中加入氯苯和溶剂(四氢呋喃),然后加入镁屑,反应制得C6H5MgCl;再从滴液漏斗中缓慢加入PCl3 , 控制反应温度在40~50℃。

相关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 部分性质 |
| 三苯基膦 | 78.5 | 377 | 与水剧烈反应 |
| 四氢呋喃 | −108.5 | 65.4 | 对环境有污染 |
| 三氯化磷 | −111.8 | 76 | 与水剧烈反应 |
装置中仪器A的名称为。与普通分液漏斗比较,使用恒压滴液漏斗的优点是:使漏斗内液体顺利滴下、。
提取(C6H5)3P后的废渣中含MgCl2、四氢呋喃、(C6H5)3P等。以该废渣为原料,获取MgCl2∙6H2O的主要实验流程如下:
![]()
其他条件相同时,水浸相同时间,水浸温度与MgCl2∙6H2O获取率关系如下图所示,分析曲线在不同温度段趋势变化的原因:A→B段;D→E段。

