 B .
B .  C .
C .  D .
D . 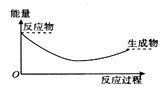


①CO(g)+H2O(g)=CO2(g)+H2(g)ΔH 0(填“>”“<”或“=”);
②过程Ⅱ是加入催化剂后的反应过程,则过程Ⅰ和Ⅱ的反应热 (填“相等”或“不相等”),原因是;
③已知:H2(g)+ O2(g)=H2O(g)ΔH=-242.0kJ·mol-1
H2O(l)=H2O(g)ΔH=+44.0kJ·mol-1
则H2(g)燃烧生成H2O(l)的热化学方程式为。

①该反应的化学方程式为:;
②t1s时反应物A的转化率为:;
③0~t1s内A的反应速率为(假设t1=6)v(A)=。
|
实验序号 |
温度 |
H2O2溶液初始浓度 |
MnO2颗粒大小 |
|
1 |
25℃ |
4% |
无MnO2 |
|
2 |
25℃ |
12% |
1g细颗粒MnO2 |
|
3 |
25℃ |
4% |
1g细颗粒MnO2 |
|
4 |
25℃ |
4% |
1g粗颗粒MnO2 |
①上表中,反应速率最快的是(填实验序号);
②设计实验2、3的目的是;
③实验3、4预期可得出的结论是。
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=。
②该反应为(填“吸热”或“放热”)反应。
③能判断该反应达到化学平衡状态的依据是。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),则此时的温度为℃。
①增加Fe的量,其反应速率(填“增大”、“不变”或“减小”,下同)。
②其它条件不变,将容器的体积缩小一半,其反应速率。
③其它条件不变,加入一定量H2 , 其平衡移动方向(填“正移”、“不移”或“逆移”,下同)。
④其它条件不变,加入一定量的催化剂,其平衡移动方向。

①锌片上的现象是锌片逐渐溶解,电极反应为;
②电流由经导线流向,说明为正极;
③当收集到氢气4.48L(标况下)时,通过导线的电子为mol。
①极发生氧化反应,电极反应式为;
②得到O2的体积(标准状况)是L。