一、选择题(本大题共15小题,第1—10小题每题4分,第11—15小题每题3分,共5分,请选出每小题一个符合题意的选项,不选、多选,错选均不给分)
-
-
2.
(2020九上·海曙期中)
中国丝绸具有几千年的历史传承,古代染坊常用一种盐来处理丝绸,可使丝绸颜色洁白,质感柔软。这种盐是下列物质中的( )
A . 碳酸钾
B . 烧碱
C . 乙醇
D . 熟石灰
-
A . 过滤悬浊液  B . 称量固体
B . 称量固体  C . 熄灭酒精灯
C . 熄灭酒精灯  D . 倾倒液体
D . 倾倒液体 
-
A . 甲物质中含有两种元素
B . 两种生成物均为氧化物
C . 丙中碳、氢原子个数比为 1:2
D . 参加反应的甲与乙的分子个数比为 1:3
-
5.
(2020九上·海曙期中)
已知反应A+2B═C+2D,8gA与足量的B恰好完全反应生成22gC和18gD,D的相对分子质量为18,则A的相对分子质量为( )
A . 8
B . 18
C . 22
D . 16
-
A . 向某固体滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐
B . 除去MgCl2溶液中混有的少量CuCl2 , 可加入适量的NaOH,充分搅拌后过滤
C . CO32﹣、Na+、NO3﹣、K+四种离子可在同一溶液中大量共存
D . 将带火星的木条伸入到装有气体的集气瓶中,木条不复燃,证明该气体中不含氧气
-
7.
(2020九上·海曙期中)
下列物质的性质与用途对应关系错误的是( )
| 选项 | 性质 | 用途 |
| A | 氢氧化钙溶液呈碱性 | 改良酸性土壤 |
| B | 浓硫酸具有脱水性 | 干燥氧气 |
| C | 稀盐酸能与某些金属氧化物反应 | 除铁锈 |
| D | 氢氧化钠能与某些非金属氧化物反应 | 吸收二氧化碳 |
A . A
B . B
C . C
D . D
-
A . ①中盛放NaOH 溶液的试剂瓶瓶塞甲是玻璃塞
B . ②中酚酞试液变红,其原因是溶液中存在 Na+
C . ③中反应的实质是 H+和OH﹣结合生成水
D . ⑤中稀释浓硫酸时,倒入的乙物质是水
-
A . 固体:NaOH、NH4NO3、NaCl(水)
B . 液体:稀盐酸、H2O、Ca(OH)2溶液(石蕊溶液)
C . 固体:ZnSO4、CaCO3、KCl(水)
D . 液体:Ba(NO3)2溶液、MgCl2溶液、K2CO3溶液(稀硫酸)
-
A . 通常情况下,碱溶液的pH大于7,碳酸钠溶液的pH值大于7,则碳酸钠属于碱
B . 化合物含有不同种元素,则由不同种元素组成的纯净物一定是化合物
C . 复分解反应中元素化合价不发生变化,则元素化合价不发生变化的反应一定是复分解 反应
D . 酸能使紫色石蕊试液变红,通入二氧化碳后的紫色石蕊试液变红,则二氧化碳属于酸
-
A .  在一定量 AgNO3和Zn(NO3)2的混合溶液中加入铁粉
B .
在一定量 AgNO3和Zn(NO3)2的混合溶液中加入铁粉
B .  向等质量的铝粉和镁粉中,分别加入相同质量分数的稀盐酸
C .
向等质量的铝粉和镁粉中,分别加入相同质量分数的稀盐酸
C .  常温下,向一定量的水中加入硝酸钾晶体
D .
常温下,向一定量的水中加入硝酸钾晶体
D .  向一定量的氢氧化钠溶液中加入过量的稀盐酸溶液
向一定量的氢氧化钠溶液中加入过量的稀盐酸溶液
-
12.
(2020九上·海曙期中)
如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲﹣戊的反应类型不同于其它几个反应;丙﹣戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )

| | 甲 | 乙 | 丙 | 丁 | 戊 |
| A | 铁 | 硝酸银 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
| B | 硝酸银 | 铁 | 稀盐酸 | 氢氧化钡 | 碳酸钙 |
| C | 硝酸银 | 铁 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
| D | 铁 | 氢氧化钡 | 碳酸钙 | 硝酸银 | 稀盐酸 |
A . A
B . B
C . C
D . D
-
13.
(2020九上·海曙期中)
现有盐酸和氯化钡的混合溶液,向其中逐滴滴入碳酸钠溶液,生成沉淀质量与滴入碳酸钠溶液质量的变化关系如图所示。下列说法正确的是( )

A . 滴至a克时,溶液中溶质为氯化钡
B . 滴至b克时,溶液中含H+、Na+、Cl﹣三种离子
C . 滴至c克时,溶液呈中性,溶液中溶质只有氯化钠
D . 滴至d克时,溶液中溶质只有碳酸钠
-
14.
(2020九上·海曙期中)
实验室有一包白色固体由K
2CO
3、K
2SO
4、KCl和CuSO
4中的一种或几种组成,实验记录如下:
①取该样品溶于水,得到无色溶液;
②取适量上述溶液加过量的BaCl2溶液,出现白色沉淀,过滤;
③向步骤②所得沉淀中加入过量的稀HNO3 , 沉淀全部消失并产生气泡。
下列分析中正确的是( )
A . 原固体中一定含有K2CO3 , 可能含有CuSO4和KCl
B . 原固体中一定不含K2SO4和CuSO4、可能含有KCl
C . 原固体中一定含有K2CO3和K2SO4 , 一定不含CuSO4
D . 若在步骤②所得滤液中滴入AgNO3溶液,出现白色沉淀,则原固体中一定含有KCl
-
15.
(2020九上·海曙期中)
某废液中只含有Fe(NO
3)
2、Cu(NO
3)
2、Ba(NO
3)
2三种溶质。为了回收金属、保护环境,小科设计了如图方案(所加试剂均过量)。下列判断不正确的是( )
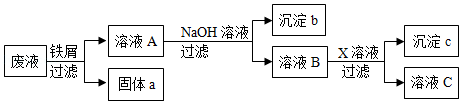
A . 向固体a中滴加过量的盐酸,实验现象为固体部分溶解,产生气泡,溶液呈浅绿色
B . 溶液B中含有的盐是Ba(NO3)2和NaNO3
C . X可能是Na2SO4
D . 若回收到6.4g固体a,则加入的铁屑质量为5.6g
二、 填空题(本大题共有 7 小题,共 18 空,每空 2 分,共 36 分)
-
16.
(2020九上·海曙期中)
某同学把自制的一种黄色花汁,分别滴加到下列不同的试剂中,并记录观察到的现象如
下表所示。
|
试剂
|
稀盐酸
|
食醋
|
蔗糖水
|
蒸馏水
|
肥皂水
|
烧碱溶液
|
石灰水
|
|
颜色
|
红
|
红
|
黄
|
黄
|
绿
|
绿
|
绿
|
请分析上表,并回答下列问题:
-
(1)
该花汁(填“可以”或“不可以”)作酸碱指示剂。
-
(2)
胃酸的主要成分是盐酸,胃舒平(主要成分 Al(OH)3)常用于治疗胃酸过多症,写出氢氧化铝治疗胃酸过多症时的化学反应方程式:。
-
17.
(2020九上·海曙期中)
物质的性质决定用途.请从①金刚石 ②铜 ③氢氧化钙
④干冰 ⑤小苏打⑥氯化钠中
选择适当物质填空(填序号)
-
-
-
18.
(2020九上·海曙期中)
自热米饭是一种快餐食品.请根据下表中信息回答下列问题:
|
营养素
|
每份含量
|
|
蛋白质
|
29.6g
|
|
油脂
|
23.5g
|
|
糖类
|
104.7g
|
|
钠
|
814mg
|
|
钙
|
130mg
|
-
(1)
自热米饭的营养素中,主要负责提供能量的是.
-
(2)
包装菜肴的材料是符合卫生标准的铝箔.铝可以压制成铝箔,说明铝具良好的.
-
(3)
该自热米饭是利用生石灰与水反应放出的热量对菜肴进行加热的,生石灰与水反应的化学方程式为,其基本反应是.
-
-
(1)
用毛笔蘸取稀硫酸在竹片上画花,然后把竹片放在小火上烘干,再用水洗净,在竹片上就得到一幅精美的呈黑色或褐色的竹片画。在烘干的过程中稀硫酸变为浓硫酸,在制作竹片画的过程中利用了浓硫酸的性;
-
(2)
在加热的条件下浓硫酸与铜反应的化学方程式是 Cu+2H2SO 4(浓)═CuSO4 +SO2↑+2X,则
的化学式是。但足量的铜和浓硫酸充分反应后溶液中仍有少量硫酸剩余,其原因是。
-
20.
(2020九上·海曙期中)
已知:(1)向氯化铝溶液中滴加氢氧化钠溶液,有白色沉淀[Al(OH)
3]生成。当继续滴加氢氧化钠溶液时,白色沉淀逐渐减少,直至消失,生成一种可溶性盐。此反应的化学方程式是:Al(OH)
3+NaOH═NaAlO
2(偏铝酸钠)+2H
2O;(2)氢氧化铁固体不溶于氢氧化钠溶液。现欲除去氯化铁溶液中混有的少量氯化铝杂质,得到较为纯净的氯化铁溶液,某同学设计了如下提纯方案:
试回答:

-
-
-
21.
(2020九上·海曙期中)
有一包白色固体,可能由BaCl
2、NaOH,Na
2CO
3、Na
2SO
4 中的一种或几种组成。为确定其成分,实验小组进行试验。实验过程中所加试剂均足量,实验过程及现象如图所示。

-
(1)
白色沉淀 A 与稀盐酸反应的化学反应方程式为。
-
-
22.
(2020九上·海曙期中)
如图是铁、盐酸、氢氧化钙、硫酸铜和氯化镁五种物质的反应与转化关系,“﹣”表示两种物质之间能发生化学反应,“→”表示在一定条件下的物质转化。

-
-
-
(3)
从物质反应规律分析,在单质、氧化物、酸、碱和盐中,能与 B 反应生成D 的物质有
(填序号)。
①2 类②3 类③4类④5 类
三、 实验探究题(本大题共有 3 小题,每空 3 共 分,共 39 分)
-
-
-
(2)
反应后试管 C 的溶液中一定有的阳离子是;
-
(3)
小明把 D、E 反应后的液体倒入一个洁净的烧杯中,观察到只有白色沉淀生成,过滤后得到白色沉淀和无色滤液,小明分别对试管 D、E 反应时的反应物用量有如下描述,正确的是
。
A.试管 D:氢氧化钙溶液一定过量 B.试管 D:稀盐酸可能不足 C.试管 E:碳酸钠一定过量 D.试管 E:稀盐酸一定过量
-
24.
(2020九上·海曙期中)
水垢主要成分是碳酸钙、氢氧化镁及少量水,实验室现有一水垢样品,为测定其中各成分的质量分数,某兴趣小组的同学利用如图所示装置进行实验(该装置气密性良好,A、C、D 中所装药品足量)。已知:①碱石灰是氧化钙和氢氧化钠的混合物;
②高温条件下,碳酸钙、氢氧化镁均易分解为两种氧化物。

-
(1)
部分实验步骤如下:
Ⅰ.取8g样品装入装置B的玻璃管中,按图连接好装置,关闭弹簧夹,给样品加热;
Ⅱ.待样品完全反应后, (填字母序号);
A . 先打开弹簧夹通入空气,再熄灭酒精喷灯,直到冷却;
B . 先熄灭酒精喷灯,玻璃管冷却后再打开弹簧夹通入空气 Ⅲ.实验完毕,测得装置
C . D 中的液体质量分别增加了 1g、2.2g; Ⅳ.根据实验所测数据计算该样品中碳酸钙、氢氧化镁和和水的质量分数。请回答:
-
-
-
-
-
25.
(2020九上·海曙期中)
某研究性学习小组对中和反应进行探究,请你参与实验:
实验 1.证明酸和碱反应有水生成:取变色硅胶(吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行图 1 所示的三个实验。

-
-
(2)
为了防止空气中的水分进入试管干扰实验,加入试剂后,迅速塞紧橡胶塞。
能证明酸和碱反应有水生成的现象是。
-
(3)
实验2.测量酸和碱反应过程的pH、温度变化:取一定量的稀盐酸,逐滴匀速滴加NaOH溶液,用传感器实时获得溶液的pH、温度曲线如图2。
由图2分析,酸和碱有发生反应的依据是。
-
(4)
通过实验测得:酸和碱的反应是反应(填“吸热”或“放热”)。
-
(5)
该实验若用氢氧化钠固体代替氢氧化钠溶液进行实验,能达到目的吗?为什么?。
四、解答题(本题共7小题,第第26、27、29、30小题各6分,第第28小题8,分,第第31小题10分,第32小题8分,共共50分)
-
-
(1)
下列是生活中常见的物质:①尿素[CO(NH2)2]②纯碱(Na2CO3)③酒精(C2H5OH)④葡萄糖(C6H12O6),属于有机物的是(选填序号)。
-
(2)
食醋是生活中常用的调味品,其主要成分是乙酸(CH
3COOH),在乙酸分子中碳、
氢、氧的原子个数比是。
-
(3)
一定质量的某有机化合物X与8克氧气恰好完全反应,生成8.8克二氧化碳和1.8克水。X中各元素的质量比为。
-
27.
(2020九上·海曙期中)
小科在实验室利用H
2O
2制取4克纯净的氧气 ,反应的化学方程式为:2H
2O
2 
2H
2O+O
2↑
-
(1)
反应后,可通过 、洗涤、干燥等步骤回收 MnO2 .
-
-
28.
(2020九上·海曙期中)
欲测定某石灰石样品中碳酸钙的质量分数(碳酸钙在高温下分解生成二氧化碳和氧化钙;石灰石样品中杂质受热不分解,且不与酸反应),甲、乙两位同学分别了设计如下两个实验方案:方案一:①称取石灰石样品 8 克;②用酒精灯加热样品,直到质量不再改变;③将固体残余物放在干燥的器皿中冷却后称的质量 6.9 克;④计算方案二:①称取石灰石样品 8克;②加入质量分数为 7.3%的盐酸 100 克,使碳酸钙完全反应;③向反应后的溶液中加含溶质 4 克的氢氧化钠溶液,恰好中和多余的盐酸;④计算请回答下列有关问题:
-
-
(2)
100克质量分数为 7.3%的盐酸中,溶质氯化氢的质量为克;
-
(3)
你认为上述方案中,切实可行的方案是 ,不选用另一方案的原因是。
-
29.
(2020九上·海曙期中)
向10g大理石样品(杂质不溶于水,也不与盐酸反应)分两次加入一定溶质质量分数稀盐酸,充分反应后烧杯内物质总质量变化如图所示。

请计算:
-
-
-
30.
(2020九上·海曙期中)
某化学兴趣小组,为了测定铜锌合金样品中锌的含量,称取样品20克于烧杯中,向其中加入50克稀硫酸至恰好完全反应,反应后烧杯中物质的总质量为69.8克,求:
-
-
(2)
恰好完全反应后所得溶液的质量和溶质的质量分数为多少?(保留到0.1%)
-
31.
(2020九上·海曙期中)
实验室有一份在空气中潮解变质的氢氧化钠样品,质量为 1.5g(含水分),某实验小组将这份样品完全溶解,配成 50g 溶液,然后缓慢滴入 7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液 pH和溶液总质量,部分数据如表所示:
|
测量次数
|
第1次
|
第6次
|
第16次
|
第31次
|
第26次
|
|
滴加的盐酸总质量/g
|
0
|
5
|
15
|
20
|
25
|
|
溶液总质量/g
|
50
|
55
|
m
|
69.78
|
74.78
|
|
溶液 pH
|
12.4
|
12.1
|
7.0
|
2.2
|
2.1
|
请分析计算:
-
-
-
(3)
样品中碳酸钠的质量分数?(保留到 0.1%)
-
-
32.
(2020九上·海曙期中)
Mg(OH)
2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含 MgSO
4和 H
2SO
4的混合溶液,为确定混合溶液中镁的含量,取 4 份混合溶液各 100g,向每份混合溶液中加入一定质量的 4%NaOH溶液,得到实验数据如下表所示:

|
实验编号
|
①
|
②
|
③
|
④
|
|
NaOH 溶液质量/g
|
10.0
|
20.0
|
30.0
|
40.0
|
|
Mg(OH)2 质量/g
|
0.232
|
0.522
|
0.580
|
0.580
|
-
-
(2)
计算 100g 混合溶液中含
MgSO4的质量?(写出计算过程)
-
(3)
分析实验数据,在图中,画出加入4%NaOH 溶液质量 0﹣30.0g过程中,产生 Mg(OH) 2 沉淀质量对应的变化图,并标注必要的数值。(写出计算过程)
 B . 其他垃圾
B . 其他垃圾  C . 有害垃圾
C . 有害垃圾  D . 厨余垃圾
D . 厨余垃圾 
 B . 称量固体
B . 称量固体  C . 熄灭酒精灯
C . 熄灭酒精灯  D . 倾倒液体
D . 倾倒液体 


 在一定量 AgNO3和Zn(NO3)2的混合溶液中加入铁粉
B .
在一定量 AgNO3和Zn(NO3)2的混合溶液中加入铁粉
B .  向等质量的铝粉和镁粉中,分别加入相同质量分数的稀盐酸
C .
向等质量的铝粉和镁粉中,分别加入相同质量分数的稀盐酸
C .  常温下,向一定量的水中加入硝酸钾晶体
D .
常温下,向一定量的水中加入硝酸钾晶体
D .  向一定量的氢氧化钠溶液中加入过量的稀盐酸溶液
向一定量的氢氧化钠溶液中加入过量的稀盐酸溶液









