
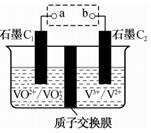
已知:i.Na2SO3+NCl3 + ![]() =Na2SO4+ HCl+NH4Cl;
=Na2SO4+ HCl+NH4Cl;
ⅱ.BaCl2+Na2SO4=BaSO4↓十2HCl。
①请完成反应i的化学方程式(横线填数字,方框中填化学式):
ⅰ Na2SO3+NCl3+ ![]() =Na2SO4+ HCl+NH4Cl
=Na2SO4+ HCl+NH4Cl
②装置B反应后的溶液中三氯化氮的浓度为mol·L-1。
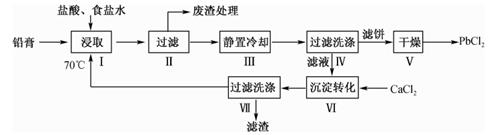
已知:①铅膏的组成如下表:
| 物相 | PbO | PbO2 | PbSO4 | Pb | 总铅 |
| 质量分数/% | 15.89 | 4.86 | 33.74 | 34.03 | 76.05 |
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。
回答下列问题:
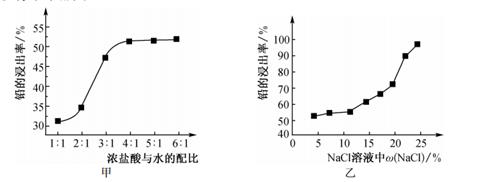
①由图甲确定适宜的配比为
②已知70 ℃时,NaCl的溶解度为37.8 g,由图乙可知铅的浸出率与NaCl质量分数的关系是,工业上采用质量分数约为24%的食盐水,不能采用无限制提高w(NaCl)来提高铅的浸出率,其原因是
③提高铅的浸出率除浓盐酸与水的配比和w(NaCl)外,还可采取的措施有(至少写2种)。
①硫酸铅溶于氯化钠生成 的离子方程式为。
②产生氯气的化学方程式为
2NO(g)+O2(g) 2NO2(g) △H=-113.0 kJ·mol-1
①反应:NO2(g)+SO2(g) SO3(g)+NO(g)的△H=kJ·mol-1。
②一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g) SO3(g)+NO(g),下列能说明反应达到平衡状态的是 (填字母)。
a.混合气体的密度保持不变.
b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变
d.每生成1molSO3的同时消耗1molNO
③测得②中反应达到平衡时NO与NO2的体积之比为37:13,则在该温度下反应:NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常数K=
CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。下列说法正确的是 (填字母)。

铁是一种常见的金属,在生产生活中用途广泛。
构型为;1 mol Fe(CO)5分子中含有σ键为mol。
C、N、O元素的第一电离能的大小顺序为
已知该晶体的密度为dg·cm-3 ,阿伏加德罗常数的值为NA , 则该晶体的晶胞参数a=pm。(用含d和NA的代数式表示)。

反应③:;反应类型为。
反应④:;反应类型为。
①-NH2直接连在苯环上;
②能与新制氢氧化铜悬浊液共热产生红色固体。