 B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 


下列说法正确的是( )

| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/ mol·L-1 | 体积/mL | ||
| ① | 0.15 | 2.0 | 0.010 | 8.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 8.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 8.0 | 50 |
| ④ | 0.15 | 4.0 | 0.010 | 8.0 | 50 |
下列说法正确的是( )
|
化学键 |
H-H |
C-O |
C≡O(CO结构式) |
H-O |
C-H |
|
E/(kJ·mol-1) |
436 |
343 |
1075 |
465 |
413 |
则△H为( )


下列叙述正确的是( )

则下列说法正确的是( )
| 容器1 | 容器2 | 容器3 | |
| 反应温度/K | 700 | 700 | 800 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
| 平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
| 平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
下列说法正确的是( )
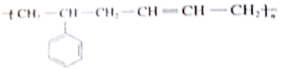

|
离子 |
|
|
|
|
Cl- |
|
c/(mol∙L-1) |
|
|
|
|
|
①写出NaClO2溶液脱硝过程中主要反应的离子方程式。
②如果采用Ca(ClO)2替代 NaClO2 , 其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比 NaClO2具有的优点是。
反应Ⅰ:
反应Ⅱ:
反应Ш:
其对应的平衡常数分别为K1、K2、K3 , 其中K1、K2随温度变化如下表所示:
|
250℃ |
300℃ |
350℃ |
|
|
K1 |
0.01 |
0.05 |
0.1 |
|
K2 |
2 |
0.2 |
0.05 |
回答下列问题:

①能说明上述反应已达到平衡状态的是(选填字母)。
A. B.CO2与H2的物质的量之比保持不变
C.H-H键、H-O键断裂速率相等 D.CH4的体积分数保持不变
②据图可知,T1T2(填“>”或“<”)。
③若反应达到平衡点A,此时容器的体积为2L,则该温度下反应Ⅲ的平衡常数K=。


滴定操作步骤:①准备:检漏→洗涤→→→排气泡→读数。
②滴定:用移液管取25.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用标准NaOH溶液进行滴定,重复上述滴定操作2-3次,记录数据如下。
|
实验编号 |
NaOH溶液的浓度(mol·L-1) |
NaOH标准液初始读数(mL) |
NaOH标准液终点读数(mL) |
|
1 |
0.1000 |
0.62 |
20.60 |
|
2 |
0.1000 |
0.72 |
20.74 |
|
3 |
0.1000 |
0.00 |
21.00 |

A.开始滴定前,滴定管尖悬挂的液滴未擦去
B.滴定终点读数时仰视读数
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.锥形瓶水洗后未干燥
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失

已知:
①
②
③G能与碳酸氢钠溶液反应
请回答: