
| 容器 | 温度/℃ | 物质的起始加入量 | 平衡时Z的物质的量 |
| 甲 | 1000 | 1molX、1molY、0molZ | 0.6mol |
| 乙 | 1000 | 2molX、2molY、0molZ | |
| 丙 | 1200 | 0molX、0molY、1molZ | 0.5mol |

| 容器 | 温度 | CO | H2 | CH3OH | H2平衡转化率 |
| Ⅰ | T℃ | amol | 2mol | 0mol | 50% |
| Ⅱ | T℃ | 0.5mol | 1mol | 0mol | 50% |
下列说法正确的是( )

下列有关说法错误的是( )


下列说法错误的是( )


下列叙述正确的是( )

 ,该物质的同分异构体中具有“本宝宝福禄双全”谐音且两个醛基相对位置不变的有机物还有( )
,该物质的同分异构体中具有“本宝宝福禄双全”谐音且两个醛基相对位置不变的有机物还有( )
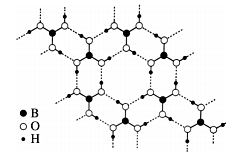
常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1 mol 硼酸(H3BO3)晶体中含有 mol 氢键。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:。
氮化铝的制备
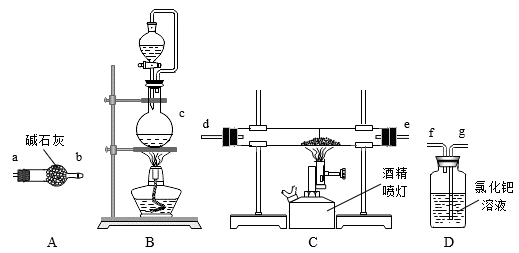
①实验中使用的装置如上图所示,请按照氮气流方向将各仪器接口连接:c→。 (根据实验需要,上述装置可使用多次)
②D装置内氯化钯溶液的作用可能是。
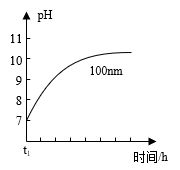
①AlN粉末水解的化学方程式是。
②相同条件下,请在图中画出粒径为40 nm的AlN粉末水解的变化曲线。
①过碳酸钠具有Na2CO3和H2O2的双重性质,50℃开始分解
②2Na2CO3(aq)+3H2O2(aq)=2Na2CO3•3H2O2(aq)△H<0
③过碳酸钠在异丙醇中的溶解度较低
实验室用Na2CO3与稳定剂的混合液和H2O2化合制备过碳酸钠,制备装置如图。

|
t/℃ |
活性氧百分含量/% |
产率/% |
|
5~10 |
13.94 |
85.49 |
|
10~15 |
14.02 |
85.78 |
|
15~20 |
15.05 |
88.38 |
|
20~25 |
14.46 |
83.01 |
a.蒸发溶剂至100℃,冷却结晶
b.蒸发至大量晶体析出,用余热蒸干
c.加入异丙醇
d.用异丙醇溶液洗涤
e.用饱和碳酸钠溶液洗涤
f.抽滤
g.加入氯化钠晶体
h.静置
①取适量过氧碳酸钠样品,用蒸馏水溶解后转移至250mL容量瓶中,定容,摇匀
②用移液管移取25.00mL于锥形瓶中,加入2-3滴甲基橙,用0.2000mol•L-1硫酸标准溶液滴定至终点。重复操作2-3次,记录数据。
③用移液管移取12.50mL于锥形瓶中,加入足量稀硫酸,用0.0200mol•L-1KMnO4标准溶液滴定至终点。重复操作2-3次,记录数据。
经计算发现过氧碳酸钠中碳酸钠与双氧水的比例大于2:3,引起上述结果可能的原因有___。
|
试剂 |
H2O2 |
H2O2+NaCl |
H2O2+Na2CO3 |
H2O2+NaOH |
H2O2+NaOH |
|
pH |
6.01 |
5.97 |
8.14 |
8.15 |
9.26 |
|
溶解氧 |
6.44 |
6.48 |
9.11 |
9.12 |
10.97 |
结合以上数据分析“鱼浮灵”溶于水后在水产养殖中速效增氧的原理是。