 B . 铁架台
B . 铁架台  C . 橡胶塞
C . 橡胶塞  D . 蒸发皿
D . 蒸发皿 




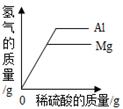
 B . 定量测定产生H2的快慢
B . 定量测定产生H2的快慢  C . 除去废气中的CO2 , 并收集CO
C . 除去废气中的CO2 , 并收集CO  D . 验证CaO和水反应放热
D . 验证CaO和水反应放热 
①CO能与Fe2O3反应生成Fe,CO也能与CuO反应生成Cu
②活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属
③有机化合物含碳元素,则含碳元素的化合物一定是有机化合物
④中和反应生成盐和水,则生成盐和水的反应一定是中和反应
⑤碱性溶液能使酚酞试液变红,则能使酚酞试液变红的溶液一定是碱性溶液
 B . 向氯化钙和稀盐酸的混合液中加入Na2CO3溶液后生成沉淀的质量
B . 向氯化钙和稀盐酸的混合液中加入Na2CO3溶液后生成沉淀的质量 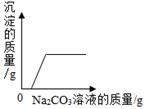 C . 向室温下的饱和石灰水中加入生石灰,溶液中溶质的质量
C . 向室温下的饱和石灰水中加入生石灰,溶液中溶质的质量  D . 向等质量、等质量分数的稀盐酸中分别加入碳酸镁和氧化镁后生成氯化镁的质量
D . 向等质量、等质量分数的稀盐酸中分别加入碳酸镁和氧化镁后生成氯化镁的质量 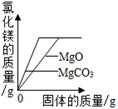


|
试剂 |
稀盐酸 |
氢氧化钠溶液 |
蒸馏水 |
白醋 |
纯碱溶液 |
|
滴加2滴紫甘蓝汁后的颜色 |
红色 |
绿色 |
紫色 |
红色 |
绿色 |






第1步:取A、B、C、D四种白色粉末各一药匙,分别放入四支洁净的试管中,各加蒸馏水2毫升,充分振荡后静置。四支试管底部均有固体存在,只有盛放A的试管中液体呈蓝色,其他均呈无色。
第2步:继续向盛放B、C、D的试管中加入适量的稀盐酸,只有盛放D的试管中有气泡产生,其他均无明显变化。
第3步:重新取少量B和C的粉末分别放入另取的2支洁净试管中,各加入适量蒸馏水使其完全溶解,再分别加入几滴硝酸银溶液,结果盛放B的试管中有白色沉淀生成,盛放C的试管中无明显变化。
试回答下列问题:

①将加热棒内的物质放入烧杯中,加入足量的水充分溶解、过滤,得到滤渣和滤液。
②取适量滤液于试管中,滴加(填写正确的实验操作),出现白色沉淀,证明滤液中含有Cl- , 在老师的指导下通过进一步的实验证明滤液中还含有Na+ , 从而确定含有氯化钠。

综合上述实验,小明验证了加热棒内的主要成分。加热棒为什么能够起到加热作用呢?小明还将进一步探究。
【提出问题】浅绿色固体的成分是什么?
【查阅资料】
①Cu(OH)2的分解温度为66 ℃~68 ℃;
②NaOH与CuSO4反应会生成Cu(OH)2 , 也会生成Cu4(OH)6SO4(碱式硫酸铜);
③Cu4(OH)6SO4不溶于水,能与酸反应,分解温度需300 ℃。
【建立假设】
猜想一:浅绿色固体为Cu(OH)2和Cu4(OH)6SO4
猜想二:浅绿色固体为Cu(OH)2
猜想三:
【进行实验】
⑴取少许浅绿色固体放入试管中,加热至100 ℃,产生黑色固体物质,说明浅绿色固体中存在。
⑵另取少许浅绿色固体放入试管中,加入足量稀硝酸,再滴加硝酸钡溶液,出现浅绿色沉淀消失,产生白色沉淀。
【结论】整个实验证明猜想是正确的。

|
选项 |
实验装置 |
反应开始前鼓入的气体 |
反应结束后鼓入的气体 |
|
A |
甲 |
氮气 |
氮气 |
|
B |
甲 |
干燥空气 |
干燥空气 |
|
C |
乙 |
氮气 |
氮气 |
|
D |
乙 |
干燥空气 |
干燥空气 |
![]()
【模型应用】同学们为检验天然气燃烧后的气体产物成分,应用思维模型设计了如图甲实验方案(固定装置未画出),将天然气在氧气中燃烧后得到的混合气体通过该方案进行实验。


实验中,小金在加热前先通一段时间的混合气体,其目的是。
|
同学 |
小红 |
小丽 |
小兵 |
|
操作 |
各取一支相同规格的试管,在试管中加入一定量的待测溶液 |
||
|
滴入无色酚酞 |
加入足量的 ? |
加入足量的BaCl2溶液 |
|
|
现象 |
变红 |
产生气泡 |
产生白色沉淀 |
|
结论 |
没变质 |
变质 |
变质 |


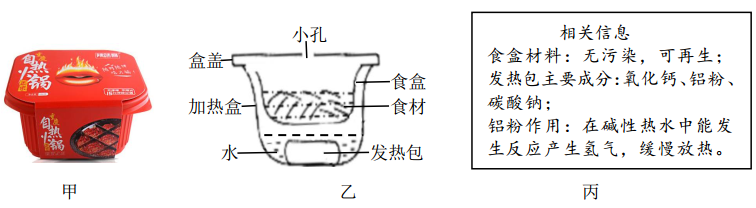
小科按食用方法进行如下操作:①加热盒中倒入适量冷水,将发热包放入冷水中:②放上食盒,加入食材并倒入适量的饮用水,扣紧盒盖。在等待食物煮熟过程中,小科发现加热盒逐渐变烫、盒内传出“嘶嘶”的声音、盒盖小孔的上方有水汽。请结合火锅“自热”过程解释盒盖上小孔的作用。