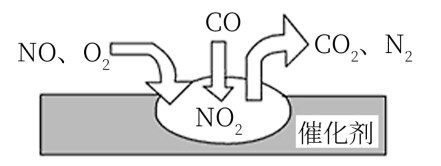


①铵根离子水解显酸性;② 与
间发生反应加热后产生氨气;③
能电离出
和
;④石蕊在碱性条件下变为蓝色
步骤1:在一支 的注射器中充入
无色气体
,然后吸入
水,用乳胶管和弹簧夹封住管口,如题图所示。振荡注射器,无明显现象。
步骤2:打开弹簧夹,快速吸入少量 后夹上弹簧夹,气体变成红棕色。
步骤3:振荡注射器,气体又变为无色,溶液仍无色。
下列说法不正确的是( )
![]()

请回答下列问题:

②假设只生成NO2 , 通过计算理论上收集到的气体体积为mL (标准状况下).
③实验最终测得气体的体积为130.5mL(标准状况下),与理论值有差异,其理由可能为.
A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO
B.过程中还发生了反应4NO+3O2+2H2O=4HNO3
C.过程中还发生了反应4NO2+O2+2H2O=4HNO3
D.硝酸具有挥发性,对实验有影响.

操作步骤 | 实验现象 | 解释原因 |
打开K1 , 推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③ | ④ |

a、可通过雷电作用将b转化为c,这是一种固氮方式
b、可通过加氧化剂将e转化为f
c、a→c→d→f这几个反应中,均发生了N元素被氧化的反应
d、g只具有氧化性,还可能与碱发生反应
e、可通过加Cu、C等还原剂,将f转化为d
f、h可与f反应生成i
NO2+NO+2NaOH=2NaNO2+H2O ①
2NO2+2NaOH=NaNO2+NaNO3+H2O ②
在反应①中,氧化剂是,还原剂是。
在反应②中,氧化剂和还原剂的物质的量之比为。
已知:①N2H4·H2O具有强还原性,易被氧化成N2。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成N2H4·H2O。
③尿素中氮元素为-3价。
回答下列问题:


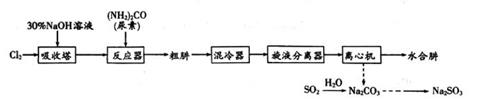
实验步骤如下:
①按照如图装置连接好仪器,关闭所有止水夹。检查装置的气密性。
②在装置A中的烧杯中加入30%的氢氧化钠溶液。在装置C的U型管中加入4.0mol·L-1的硝酸,排除U型管左端管内空气。
③塞紧连接铜丝的胶塞,打开止水夹K1 , 反应进行一段时间。
④进行适当的操作,使装置C中产生的气体进入装置B的广口瓶中,气体变为红棕色。气体进入烧杯中与氢氧化钠溶液反应。
回答下列问题:
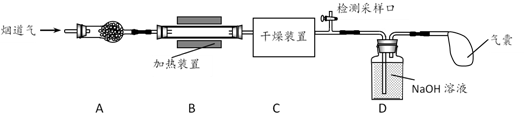
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4·5H2O)
①若反应后尾气无残留,则参加反应的NO2、NO物质的量比值为(填字母)。
a.≥1 b.≤1 c.任意值
②可使用适量酸性H2O2溶液,将溶液中的NO2-全部氧化为NO3- , 发生反应的离子方程式是。
步骤一、取适量(2)中H2O2处理后的溶液,调节pH至中性,蒸发浓缩,得到c(NO3-)为0.100mol·L-1的溶液甲。
步骤二、现量取50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中对溶液乙进行氮脱除。
步骤三、重复实验2~3次,溶液中NO3-的残留情况与反应时间的关系如图所示。

①金属铝和金属铁在0~3h内,NO3-的脱除效率均很低,几乎没被脱除,其可能的原因是。
②0~3h内铝铁合金的氮脱除效率比金属铝、金属铁大得多,其可能的原因。