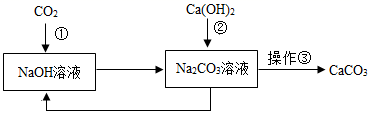
①海水“晒盐”②海水“制碱”③海水淡化④海水制镁
| 物质 | 厕所清洁剂 | 橘子 | 西瓜 | 鸡蛋清 | 肥皂 | 炉具清洁剂 |
| pH | 1~2 | 3~4 | 6-7 | 7-8 | 9-10 | 12~13 |
 B . 称量NaOH固体
B . 称量NaOH固体 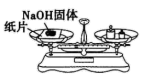 C . 量取一定体积的水
C . 量取一定体积的水  D . 溶解NaOH固体
D . 溶解NaOH固体 
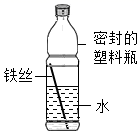
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀最严重
③铁锈的主要成分是四氧化三铁
④一段时间后,塑料瓶可能会变瘪
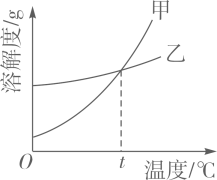
| 温度/℃ | 20 | 40 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 117 | 121 | 126 | 139 |
| KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
A.酚酞试液 B.pH试纸 C.KOH D.NaCl

吸收剂 | 碳酸钠 | 碳酸钾 |
20℃时最高浓度(g/L) | 212 | 1104 |
根据表中信息,选择碳酸钾溶液作吸收液的优点是。

A溶解 B蒸发
B蒸发 C过滤
C过滤 D取一定量的粗盐
D取一定量的粗盐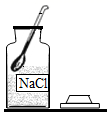
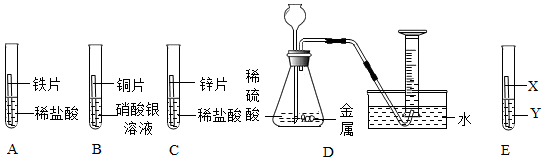
(查阅资料)Na2SO4溶液呈中性。
(假设猜想)针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4 , H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的,不合理的猜想是。理由是。
①丙组同学取少量烧杯中的溶液加入试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有。
②为了验证其余猜想,各学习小组利用烧杯中溶液,并选用老师提供的pH试纸,铜片,BaCl2溶液、溶液,进行如下三个方案的探究。
实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比标准比色卡,pH<7 | 产生白色沉淀 | |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的。
①实验操作中的不正确是。
②实验方案中也有一个是错误的,错误的原因是。
①在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑。
②根据所学化学知识验证烧杯内溶液中的溶质含有H2SO4 , 除以上正确方案外,下列哪些物质单独使用也能完成该实验?。
a.铜 b.氧化铜 c.紫色石蕊溶液 d.硝酸银溶液
③烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是(写一条)。
①现要配制120kg溶质质量分数为20%的氯化钠溶液,需要取用固体氯化钠kg。
②用60kg溶质质量分数为20%的氯化钠溶液,可稀释成12%的氯化钠溶液kg。