 取用粗盐
B .
取用粗盐
B .  过滤粗盐水
D .
过滤粗盐水
D . 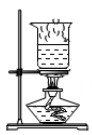 蒸干滤液
蒸干滤液


选项 | 实验目的 | 实验方案 |
A | 检验CH4中混有H2 | 点燃,在火焰上方罩一干冷烧杯,观察现象 |
B | 分离MnO2和KCl两种固体 | 加水溶解、蒸发、结晶、烘干 |
C | 鉴别NH4Cl和NH4NO3两种固体 | 取样,加熟石灰混合研磨,闻气味 |
D | 验证Fe、Cu、Ag三种金属的活动性强弱 | 将洁净的铜丝分别放入硝酸银溶液和硫酸亚铁溶液中,观察现象 |



①t1℃时,将10克甲物质加入到25克水中,充分溶解后,所得溶液中溶质和溶剂的质量比是(写出最简整数比)。
②t2℃时,甲溶液的溶质质量分数与丙溶液的溶质质量分数相比,前者和后者的关系是(填字母)。
A.大于 B.等于 C.小于 D.无法确定
③将t2℃时等质量甲、乙、丙三种物质的饱和溶液降温到t1℃时,所得溶液的质量由大到小的顺序是。

将适量的蔗糖(化学式:C12H22O11)放入烧杯中,加入几滴水,搅拌均匀:然后再加入适量浓硫酸,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生有刺激性气味的气体,如图1所示。
①生成的黑色物质是(写名称),上述实验现象表明浓硫酸具有性。
②蔗糖属于六大基本营养素中的。
【稀硫酸(1:4)是指浓硫酸(溶质的质量分数为98%,密度为1.84g/cm3)与水(密度为1g/cm3)按体积比1:4进行混合所得的硫酸.】
①配制稀硫酸(1:4)。实验步骤如下:
i.计算:配制该稀硫酸584克需浓硫酸mL。
ii.量取:用量筒量取所需的水,倒入烧杯中,另取一量筒,量取浓硫酸。
ⅲ.:在该过程中,不能将水直接倒入浓硫酸中进行稀释,其原因是。
ⅳ.将配制好的稀硫酸倒入试剂瓶中,盖好瓶塞并贴上标签。
②制取氢气。如用图2装置收集氢气时,发生装置应该与导管(填“a”或“b”)相连接。
③处理反应后的废液。若要除去废液中残余的H2SO4:得到硫酸锌溶液,请设计实验并完成下表。
实验步骤 | 实验现象 | 结论或解释(用化学方程式表示) |

已知:锂元素在元素周明表中的位置和原子结构如图:


【查阅资料】
I.溶液pH大于8.8时,Fe2+可完全转化为Fe(OH)2沉淀。
II.FeCO3是白色固体,难溶于水,遇氧气、水会发生反应,生成Fe(OH)3;遇酸也会发生反应。
III.FeCl3溶液中滴加KSCN溶液,溶液会变为血红色,而FeCl2溶液中滴加KSCN溶液,溶液不变色。
【进行实验】
①兴趣小组的同学将已生锈的铁钉放入稀硫酸中除锈,该反应的化学方程式为。
②将除尽铁锈后的铁钉再放入足量的稀硫酸中,反应完成后发现溶液中有少量黑色固体出现,说明除锈后的铁钉属于(填“纯金属”或“合金”)。
③用上述溶液和pH=11.9的Na2CO3溶液反应制取FeCO3时,可能制得FeCO3的操作是(填字母)。
A.将少量的FeSO4溶液与大量的Na2CO3溶液同时加入到烧杯中,边加边搅拌
B.先将Na2CO3溶液加入烧杯中,再缓慢加入FeSO4溶液,边加边搅拌
C.先将FeSO4溶液加入烧杯中,再缓慢加入Na2CO3溶液,边加边搅拌
D.先将NaCO3溶液加入烧杯中,再加入过量稀盐酸,最后加FeSO4溶液,边加边搅拌
实验I:
①取少量久置于潮湿空气中的FeCO3固体于试管中,加入足量的稀盐酸,观察到试管内,说明该固体中含有FeCO3。
②取少量上述反应后的溶液于试管中,进行了下一步实验操作,该操作是,可观察到,说明久置于空气中的FeCO3固体中还含有Fe(OH)3。
该兴趣小组为进一步确定固体中FeCO3的质量分数,称取10.0g固体做了如下图所示的补充实验。

①装置A的分液漏斗中盛放的溶液可以为(填字母);装置C中盛放的溶液最合适的是(填字母)。
A.浓盐酸 B.稀硫酸 C.氢氧化钠溶液 D.氢氧化钙溶液
②反应结束后,继续通入一段时间N2的目的是。
③实验结束后,测得装置C和D共增重0.44g,则固体中FeCO3的质量分数为。
【实验结论】碳酸亚铁在潮湿的空气中易变质,故需要密封保存。