
 取用粗盐
B .
取用粗盐
B .  过滤粗盐水
D .
过滤粗盐水
D . 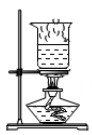 蒸干滤液
蒸干滤液

已知:①相同条件下,气体的体积比等于气体的分子个数比;
②常温常压时,1L水可溶解0.031LO2、0.403LO3。
选项 | 物质(括号内为杂质) | 试剂及操作方法 |
A | Fe粉(Cu粉) | 加入过量稀盐酸,过滤 |
B | CO2(CO) | 点燃 |
C | KNO3溶液(NaCl) | 蒸发结晶,过滤 |
D | NaCl溶液(NaOH) | 适量稀盐酸 |


A.托盘天平 B.烧杯 C.药匙 D.量筒 E.漏斗

①选择钛合金作为螺丝材料,是因为合金的硬度比组成金属的硬度(填“大”或“小”)。
②工业上可通过下面两种方法制金属钛:
方法一:TiCl4在高温下与过量的Mg反应可制取金属钛,同时生成氯化镁。除去所得金属钛中混有的少量金属镁可用的试剂是。
方法二:高温下电解熔融的TiO2来制取金属钛,反应方程式为,电解过程中需定期更换石墨电极,原因是。
①某锂电池放电时反应:4Li+2SOCl2=4LiCl+S+SO2↑,能量转化形式为。请标出产物LiCl中锂元素的化合价。电池级碳酸锂生产反应之一为氯化锂(LiCl)溶液与碳酸钠溶液发生复分解反应,该反应的化学方程式为 。
②题图是某电池手机在不同温度下的电压与待机时间的关系变化图像。当电压低于3.6V,手机会自动关机。请分析手机电池在冬天不耐用的原因是。

Ⅰ.石墨与金刚石互称为同素异形体,从微观角度看两者性质差异的主要原因是。从石墨中分离出单层石墨片(石墨烯)是目前人工制得的最薄材料,单层石墨片中碳元素以存在(填“单质状态”或“化合物状态”)。
Ⅱ.CO2与CO的化学性质不同,是因为。
Ⅰ.煤、和天然气等化石燃料的燃烧会产生大量CO2 , 过多的CO2排放会导致加剧。
Ⅱ.提倡“低碳生活”是当今社会的生活理念,以下建议可行的是。
A.减少使用一次性餐具
B.推广使用光伏发电
C.提倡使用可循环购物袋
D.禁止使用化石燃料
Ⅰ.加压水洗法可捕集CO2
Ⅱ.石灰石循环法捕集CO2(如图所示)

使空气中CO2含量减少的原因是(用化学方程式表示)。上述设想的优点有(填字母)。
A.原料可循环利用
B.有效利用太阳能
C.可全天候使用
甲烷与二氧化碳反应生成两种可燃性气体的微观示意图如图:

Ⅰ.在框内补充丙的微观模型图。
Ⅱ.反应难点之一是破坏甲烷分子的稳定结构,分为(填微粒名称)并重新组合。
我们的胃液呈酸性,是因为胃腺壁细胞能分泌出盐酸。胃酸在人体的消化吸收中发挥着重要作用,如为胃蛋白酶提供适宜的酸性环境,分解食物中的结缔组织和肌纤维使其易于被消化吸收。
你知道吗?深受人们喜欢的早餐食品燕麦中常添加颗粒极小的铁粉,它既可以作为双吸剂(起到干燥和减缓食品变质的作用),还可以作为人体补铁剂。要把铁粉变为人体需要的、能吸收的营养元素,就离不开胃酸的帮助。
健康人胃液的pH在0.9~1.5,胃液的pH不仅影响人的消化吸收功能,还对伴随食物进入胃内的各类病菌的繁殖有影响。某医院对99位胃溃疡和十二指肠溃疡等患者胃液的pH及胃液中的病菌进行了检测,结果如下表:
分组 | 胃液的pH | 受检患者人数 | 胃液中检出病菌的人数及比例 |
A | ≤2.0 | 7 | 0 |
B | 2.0~4.0 | 13 | 3(23.1%) |
C | 4.0~6.0 | 26 | 17(65.4%) |
D | >6.0 | 53 | 45(84.9%) |
胃酸过多会对胃黏膜具有侵蚀作用,并使人感觉反酸或烧心。治疗胃酸过多的药主要有两大类:一是抑酸药,能抑制胃酸分泌,但本身不能和胃酸反应;二是抗酸药,能直接与胃酸反应,常见的抗酸药有:碳酸氢钠、氢氧化铝、氧化镁、氢氧化镁和碳酸钙等。
胃溃疡患者若服用不合适的抗酸药,会因胃内气体压力增大而引起胃穿孔。患者如长期使用抗酸药,很可能刺激胃酸分泌过多。因此,应遵医嘱合理使用抗酸类和抑酸类药物。
依据文章内容,回答下列问题。

(资料:NO2有毒,常温下为红棕色,实验中常用氢氧化钠溶液进行尾气处理;同温同压下,不同气体的体积之比等于分子个数之比。)
现将收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按如图装置进行实验。

①打开K1 , 推动注射器活塞,使X中的气体缓慢通入Y中,Y管中的现象,化学方程式为。同温同压下参加反应的NH3和NO2的气体体积比为。
②将注射器活塞退回原处并固定,待装置恢复到室温,Y中有少量水珠。
③打开K2 , 观察到的现象,原因是。
【实验步骤】
①取一块订书钉(40根钉),如图甲所示,浸入酒精中,一段时间后从表面取下一层胶水薄膜;
②用棉花擦去酒精,待干燥后称量质量为m1;
③将其放入图乙所示装置,并在干燥管口用氢气传感器测量氢气的质量,同时记录电子天平显示的质量变化(如图丙所示);
④5.8min时停止反应取出装置剩余订书钉,洗涤、干燥、称量、剩余订书钉质量为m2.
根据实验操作,分析实验数据,请回答:
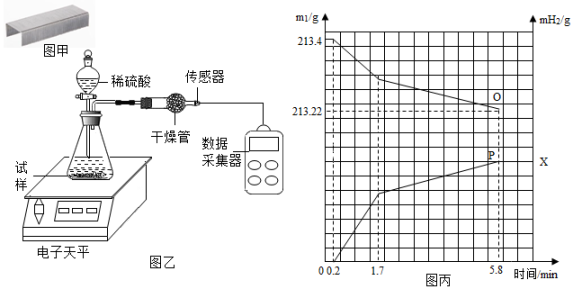

实验过程中瓶内氧气含量先减少后基本不变的原因。
该兴趣小组同学设计了如下流程:

已知:①硫酸锌晶体难溶于酒精
②硫酸锌晶体受热易逐步失去结晶水
酸浸时温度和时间对锌浸出率的影响见下图。为了提高锌的浸出率,反应的最佳条件是。
酸浸时间/h | 酸浸温度/℃ | 锌浸出率/% |
2 | 80 | 87 |
2 | 90 | 95 |
2 | 110 | 85.3 |
3 | 95 | 94.5 |
2.5 | 95 | 94 |
学习小组取5.74g硫酸锌晶体(ZnSO4•xH2O)进行加热分解,获得相关数据,并绘制成剩余固体质量一温度的关系图。

280℃时,固体完全失去结晶水。根据图中数据,计算ZnSO4•xH2O中x的值为;加热过程中,硫酸锌晶体分步失去结晶水。请写出60℃到80℃时反应方程式