 可回收物
B .
可回收物
B .  有害垃圾
C .
有害垃圾
C .  厨余垃圾
D .
厨余垃圾
D .  其他垃圾
其他垃圾




| 实验目的 | 实验步骤 |
| A.将20g20%的氯化钠溶液配制成10%的溶液 | ①加入20g20%的氯化钠溶液;②加入40g水;③搅拌 |
| B.鉴别软水 | ①取少量样品;②滴入适量肥皂水;③搅拌,出现较多浮渣 |
| C.验证KCl不能无限溶解 | 20℃时,①加入50g水;②加入9gKCl搅拌;③加入8gKCl搅拌(已知:20℃时,KCl的溶解度为34g) |
| D.配制50g溶质质量分数为5%的氯化钠溶液 | ①加入2.5gNaCl;②加入47.5g水;③搅拌至全部溶解 |

| 选项 | 物质 | 目的 | 主要实验过程 |
| A | MnO2、KCl固体 | 分离 | 加水溶解、过滤、洗涤滤渣 |
| B | H2中混有HCl气体 | 除杂 | 通入饱和碳酸钠溶液 |
| C | NaOH 溶液混有Na2CO3 | 除杂 | 滴加适量的Ca(NO3)2溶液,过滤 |
| D | 氢氧化钠、硝酸铵 | 鉴别 | 取样于试管中,分别加入适量的水,振荡 |
 当蒸发皿中出现大量固体时停止加热
B .
当蒸发皿中出现大量固体时停止加热
B .  检查装置气密性
C .
检查装置气密性
C .  用托盘天平称量固体NaOH
D .
用托盘天平称量固体NaOH
D .  探究反应物浓度对反应速率的影响
探究反应物浓度对反应速率的影响

①反应1的基本类型为。
②反应2中碳元素的化合价(填“升高”“不变”或“降低”)。
|
吸收剂 |
Na2CO3 |
K2CO3 |
|
20℃最高浓度(g/L) |
212 |
1104 |
|
价格(元/Kg) |
1.25 |
9.80 |
根据表中信息,选择K2CO3溶液作吸收液的优点是。
| 水质 | 湖水 | 蒸馏水 | 自来水 |
| 起始溶解氧量(mg/L) | 1.48 | 1.46 | 0.85 |
| 最终溶解氧量(mg/L) | 3.36 | 3.28 | 2.79 |
| 溶解氧增值(mg/L) | 1.88 | 1.82 | 1.94 |
进行实验时,不需要控制的前提条件是 。
① ;
② ,
Y的化学式是。反应①和②中化合价均未发生变化的元素是。吸收6.4KgSO2能产生30%的Y溶液Kg。(保留一位小数)
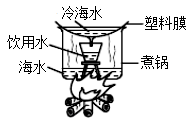
①冷海水的作用是。图中得到的饮用水属于(混合物或纯净物)。
②从微观角度分析上述过程,下列说法正确的是(填序号)。
A.蒸发时水分子体积变大
B.冷凝时水分子质量减小
C.蒸发时水分子运动速率加快
D.冷凝时水分子间隔减小
![]()
|
单质 |
引起酸雨的氧化物 |
酸 |
含氮的不同化合价的盐 |
|
N2 |
|
HNO3 |
|

请设计理论上制备硝酸镓的三种方案(要求含镓原料分别属于不同的化合物类别)
| 方案 | 预期反应的化学方程式 |
| ① |
|
| ② |
|
| ③ |
|
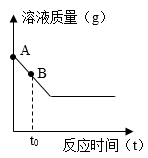
①加热过程中,其质量随时间的变化如图所示。据此判断,从200℃到50℃间固体是否还存在结晶水,并作出解释。(是或否),。

②写出一个能与硫酸铝溶液发生反应的原子团。(写离子符号)

| 实验编号 | 药品 |
| Ⅰ | 块状大理石、10%H2SO4溶液 |
| Ⅱ | 块状大理石、7%HCl溶液 |
| Ⅲ | 大理石粉末、7%HCl溶液 |
①图中丙对应实验(选填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②不用甲对应的药品,理由是。
①组装能随意添加双氧水的装置。应选用(选单编号)。写出仪器c的名称。写出用双氧水、二氧化锰制取氧气的化学方程式。


②收集氧气。用上图装置收集时,空气从端排出。
③写出用②收集氧气验满的方法。
查阅资料:碳酸氢钾可溶于水,难溶于乙醇。100℃时开始分解,200℃时完全分解,产生二氧化碳和碳酸钾等物质。
a.取少量样品于烧杯中,加入足量的水溶解,得到无色溶液A
b.取少量溶液A于试管中,滴入酚酞,溶液变红色
c.取少量溶液A于试管中,滴入足量的稀硝酸,再滴入适量氯化钡溶液,产生气泡,得到无色溶液B
d.取少量溶液B于试管中,滴入适量硝酸银溶液,有白色沉淀产生
|
实验操作 |
预期现象与结论 |
|
|
若,则该样品含有可能存在的成分; 若,则该样品不含可能存在的成分。 |