| A | B | C | D |
| | | | |
| 验证非金属性:S>C>Si | 实验室制乙烯 | 蒸发结晶获得晶体FeSO4·7H2O | 用于除去气体中的杂质 |
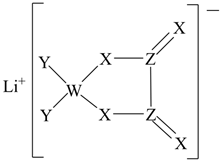

[已知:4 +6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]

制备 的化学反应方程式为;
实验过程如下表:
|
实验序号 |
假设 |
实验内容 |
结论 |
|
① |
与溶液中c(H+)有关 |
取适量上述血红色溶液,滴入Y溶液,溶液又变为黄色 |
假设不成立 |
|
② |
与c(H2SO3)或c(SO2)有关 |
1溶液中,滴入1mol/LNaHSO3溶液,溶液呈血红色,再逐滴滴入HCl溶液,出现×××现象 |
假设不成立 |
|
③ |
与c( | 在FeCl3溶液中加入Na2SO3溶液,立即变为血红色。 |
实验①中,Y是(填化学式);实验②中现象是;实验③的结论是。
在0.5mL1mol/L的FeCl3溶液中,加入浓度相同的Na2SO3溶液V1mL,NaHSO3溶液V2mL并混合均匀,改变V1、V2的值并维持V1+V2=4.0进行多组实验,测得混合溶液的吸光度与 的关系如图所示。(已知吸光度越大,溶液颜色越深)。

①维持V1+V2=4.0的目的是。
②该实验得出的结论是。
i.CH4(g)⇌C(s)+2H2(g) △H1=+75.0kJ/mol
ii.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2=+41.0kJ/mol
iii.CO(g)+H2(g)⇌C(s)+H2O(g) △H3=-131.0kJ/mol

①该历程中最大能垒E(正)=eV/mol;
②其它条件相同时,催化重整的主反应在不同催化剂下反应相同时间,CO的产率随反应温度的变化如图所示:

B是合金催化下CO的产率随温度的变化曲线,A、B曲线到达W点后重合,请解释原因。

①A、B两点对应的CO正反应速率v正(A)v正(B)(填“<”“=”或“>”,下同),B和C两点对应的反应温度TBTC。
②已知反应速率v正=k正x(CO)x(H2),v逆=k逆x(H2O),k为反应速率常数,x为气体的体积分数,在达到平衡状态为D点的反应过程(此过程为恒温)中,当某时刻CO的转化率刚好达到60%时, =。(用含k正和k逆的式子表示)
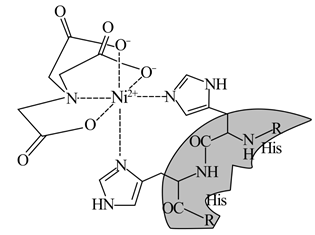
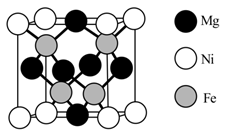
①与Ni2+配位的原子形成的空间构型为。
②配体N(CH2COO-)3中4种元素的I1从大到小的顺序为(用元素符号表示)。
③已知N……Ni存在大π键,其结构中氮原子的杂化方式为。
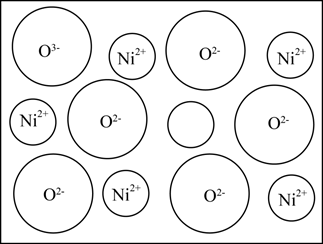
①能使FeCl3溶液显紫色
②能发生水解
③苯环上有三个取代基且只有两种不同化学环境的氢