
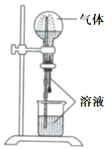
|
气体 |
溶液 |
|
|
A. |
H2S |
稀盐酸 |
|
B. |
HCl |
稀氨水 |
|
C. |
NO |
稀H2SO4 |
|
D. |
CO2 |
饱和NaHCO3溶液 |

 )是工业上常用的交联剂,可用于制备高性能分子聚合物,下列关于1,3-异丙烯基苯的说法正确的是( )
)是工业上常用的交联剂,可用于制备高性能分子聚合物,下列关于1,3-异丙烯基苯的说法正确的是( )
 )互为同系物
D . 可作为萃取剂将溴水中的溴分离出来
)互为同系物
D . 可作为萃取剂将溴水中的溴分离出来

| n/mol t/min | n(A) | n(B) | n(C) |
| 0 | 2.0 | 2.4 | 0 |
| 5 | 0.9 | ||
| 10 | 1.6 | ||
| 15 | 1.6 |
①铝土矿中 的晶体类型;
②比较 的简单离子半径大小;
③ 最外层电子的电子云形状为。
与
的化学性质相似,在
溶液中逐滴加入
溶液直至过量,可观察到的现象是。

用离子方程式表示 溶液中的转化平衡。
①属于芳香醇 ②有5种不同化学环境的H原子
 )为原料,设计制备
)为原料,设计制备 (合成路线常用的表达方式为: )
①溶液配制:称 样品,用(填仪器名称)配制成
溶液。
②滴定:取 标准溶液
,硫酸酸化后加入过量
溶液,发生反应:
。然后用
溶液滴定至淡黄绿色,发生反应:
。加入少量淀粉作为指示剂,继续滴定,当溶液即为终点。平行滴定3次,样品溶液的平均用量为
,则样品的纯度为(保留两位小数)。