 硅太阳能电池
B .
硅太阳能电池
B .  锂离子电池
C .
锂离子电池
C .  太阳能集热器
D .
太阳能集热器
D .  燃气灶
燃气灶
选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
A | 浓盐酸、浓硫酸 | 湿润的pH试纸 | 变红 | HCl为酸性气体 |
B | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
C | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3溶于水显碱性 |
D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
①SiO2 ②H2SiO3 ③Na2O2 ④Al(OH)3 ⑤FeCl3 ⑥CaSiO3
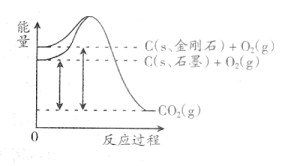
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加少量CuO固体 ⑤加NaCl溶液 ⑥升高温度(不考虑盐酸挥发) ⑦改用10mL0.1mol·L-1的盐酸


选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaOH | 制氯气并吸收尾气 | |
B | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸>硅酸 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |


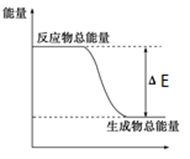
①C的生成速率与C的消耗速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再改变
④混合气体的密度不再改变
⑤混合气体的总压强不再改变
⑥混合气体的总物质的量不再改变
⑦A、B、C、D浓度之比为1:3:2:2
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
其中,时间段min内反应速率最大(选填“0~1”、“1~2”、“2~3”、“3~4”或“4~5”),不是其他时间段的原因是。

①t1时,正、逆反应速率的大小关系为v正v逆(选填“>”、“<”或“=”)。
②4min内,CO的平均反应速率v(CO)=mol·L-1·min-1。

①2min时反应是否处于平衡状态(选填“是”或“否”)。
②0~2min内的平均反应速率v(H2)=mol·L-1·min-1 , 平衡时CH4的转化率为[转化率=×100%]。
化学键 | H—H | H—O | I—I | H—I | O=O |
键能kJ·mol-1 | 435 | 460 | 150 | 300 | 500 |
①由氢气与氧气生成18g水放出的热量为kJ。
②若将1molI2和1molH2置于密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25℃,101kPa)远小于15kJ,你认为最可能的原因是。

已知:西红柿、苹果果汁都是显酸性。
实验编号 | 水果种类 | 电极间距离/㎝ | 电流大小/µA |
① | 西红柿 | 1 | 98.7 |
② | 西红柿 | 2 | 72.5 |
③ | 苹 果 | 2 | 27.2 |
请回答下列问题: