 C .
C . 
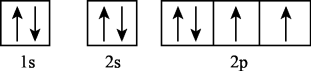 B .
B .  D .
D . 



下列说法错误的是( )
![]()
①步骤Ⅰ反应所涉及元素的第一电离能由大到小的顺序是(填元素符号)。根据下图所示物质反应过程中的能量变化,写出用石英砂和焦炭制取粗硅,同时生成CO的热化学方程式:。

②步骤Ⅱ产物中含有(沸点为33.0℃),还有少量
(沸点为57.6℃)和HCl(沸点为-84.7℃)。若先将步骤Ⅱ产物降至室温,提纯
, 方法是。所用到的玻璃仪器除酒精灯、温度计、锥形瓶、尾接管外,还需要、。
①向盛有饱和溶液(滴有酚酞溶液)的试管中通入过量
;充分反应后,用激光笔照射上述液体时发现有光亮的通路。预测液体颜色的变化:;写出该反应的离子方程式:。
②写出原硅酸脱水得到的产物(写两种)、。
ⅰ.苯环上有4个取代基,其中3个是羟基
ⅱ.苯环上仅有1种环境的氢
ⅲ.不含碳碳双键
写出其中核磁共振氢谱有6组峰的结构简式:。



①装置a的最佳选择为(填“图3”或“图4”)。

②装置b中的作用是。
①常温下,同学甲在上图实验结束后,用pH计测装置e中溶液的pH=1.00。
ⅰ.这说明e中发生的反应可能为(写化学方程式)。
ⅱ.同学乙做同样实验,测得e中溶液的pH=6.00,可能原因是。
②用如图所示装置进行硝酸与铜的反应实验。

ⅰ.请在h方框中补全该实验所需装置图并标注所需试剂。
ⅱ.硝酸一般盛放在棕色试剂瓶中,请用化学方程式说明其原因:。
ⅲ.g中为稀硝酸时,反应开始后,g中溶液颜色变蓝。写出g中反应的离子方程式:。
ⅳ.g中为浓硝酸时,g中溶液颜色变绿。反应较ⅱ中剧烈许多的原因是。
ⅴ.对比ⅲ与ⅳ反应后g中溶液颜色,推测其原因是ⅳ反应后g溶液中溶有且达饱和。为证明该推测正确,向ⅳ反应后g溶液中加入,会观察到溶液颜色由绿色变为蓝色。
ⅵ.已知(aq)呈蓝色、
(aq)呈黄色。取ⅰ中少量蓝色溶液于试管中,向其中滴加饱和NaCl溶液,观察到溶液颜色由蓝变为蓝绿色,再加热该混合溶液,溶液颜色逐渐变为黄绿色。结合离子反应方程式解释其原因:。

①实验中的作用是。
②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当pH>12时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为。

③为使沉淀完全,调控溶液的pH最小值为。

①写出发生交换反应的平衡常数表达式,
。
②当pH>4时,Cr(Ⅵ)去除率下降的原因是。
①酸性废水中的Cr(Ⅵ)离子存在的主要形式为。
②当沉淀出2mol 时,阳极至少消耗mol Fe。