 B .
B .  C .
C .  D .
D . 

 检查装置气密性
B .
检查装置气密性
B .  测定溶液酸碱度
C .
测定溶液酸碱度
C .  过滤悬浊液
D .
过滤悬浊液
D .  稀释浓硫酸
稀释浓硫酸

选项 | 实验目的 | 实验方案 |
A | 检验氯化钠溶液中含有盐酸 | 取样,滴加紫色石蕊试液,观察现象 |
B | 除去NaOH溶液中的Na2CO3 | 加入适量的CaCl2溶液,过滤 |
C | 分离MnO2和KCl的混合物 | 溶解、过滤、洗涤固体并烘干,蒸发滤液 |
D | 鉴别化肥CO(NH2)2和NH4NO3 | 取样,加Ca(OH)2固体混合研磨,闻气味 |

①2022年北京冬奥会,碲化镉发电玻璃成为绿色和科技办奥交汇的创新点。如图是碲的原子结构示意图,有关信息正确的是。(填字母)
A.碲是金属元素
B.碲的核电荷数为52
C.相对原子质量为128克
D.蹄原子在化学变化中容易得到电子
②冬奥会“飞扬”火炬科技亮点之一是采用氢气作为燃料,其优点是什么(答出一点);
③冬奥会国家速滑馆“冰丝带”采用面向未来的单层双向正交马鞍形索网结构,减少屋顶使用钢材2800吨。金属资源储量有限,钢铁生锈是世界面临的难题。铁生锈需要。
④国家游冰中心使用“水冰转换”技术,使水立方变冰立方,适合冰壶运动。“水冰转换”属于(填“物理”或“化学”)变化。冰壶的成分有二氧化硅(SiO2),其中硅元素的化合价为。
①需要氢氧化钠固体的质量为g。
②称量时,氢氧化钠固体应放在(填“滤纸”或“烧杯”)中。
③下列说法或操作正确的是(填字母)。
A.配制该溶液时所需的玻璃仪器中不包括玻璃棒
B.用量程为100mL的量筒量取所需要的水
C.将称量好的固体倒入装有水的量筒中溶解
④在量取水的体积时,若采用仰视的方法读数,则所配制的氢氧化钠溶液中率质的质量分数将(填“偏大”或“偏小”)。
①白磷的着火点为40℃。实验室常将少量白磷保存在盛有水的广口瓶中,由图甲可知,白磷不与水反应,不溶于水且(填一物理性质),其中水的作用是。
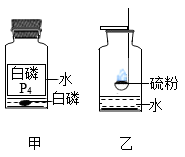
②图乙所示实验中,水的作用是。若取用的硫粉过多,实验时需将燃烧终止,在不增加仪器与药品的前提下,可采取的措施是。
①此方法中采用“喷雾”的优点是。
②流程中可循环利用的物质为丁,请写出丁与水反应转化为Ca(OH)2的化学方程式:。
③该流程虽然简单,但从节能减排的角度看,存在的不足是,这将是小张同学以后运用化学知识需改进的地方。
转化Ⅰ:一种实现二氧化碳转化为重要原料二甲醚(C2H6O)的途径如下:

反应①是二氧化碳与一种常见单质反应生成甲醇和水,该单质为(填化学式)。反应②是甲醇通过分解反应生成二甲醚和水,反应中生成的二甲醚和水的分子数之比为。
转化Ⅱ:2020年哥伦比亚大学化学团队开发出了镍基双金属催化剂,用来将二氧化碳和甲烷两种温室气体在一定条件下进行重整得到两种气体燃料。反应过程如图3所示,写出反应的化学方程式,反应一段时间后该催化剂的催化效果降低的原因是。反应中各物质的量随温度变化的曲线如图4所示,纵坐标数值越大表示该物质越多,由此可知,反应应在(填“较低”或“较高”)温度下进行。



写出实验室用AE装置组合制取某种气体的化学方程式,用E装置收集该气体,气体从(填“a”或“b”)端进入。
实验测得烧杯中溶液的pH随时间的变化关系如图3所示,c点所示溶液加热蒸干所得固体是(填化学式)。
①溶液的颜色从红色变为无色;②溶液的pH。
从压强变化的角度探究。
①利用图4装置进行实验,先挤压胶头滴管,再打开止水夹,观察到烧瓶内形成红色“喷泉”,原因是烧瓶内压强(填“大于”或“小于”)外界大气压;
②利用图5装置进行实验,分别将等体积的NaOH溶液和水同时注入盛有等体积CO2的玻璃容器中。证明CO2与NaOH溶液发生反应的实验现象是。

①ab段对应反应的化学方程式;
②bc段压强不变的原因是;
③证明CO2与NaOH溶液发生反应的实验现象是。

已知:a软锰矿的主要成分是MnO2 , 黄铁矿的主要成分是FeS2 , 两矿中都含有SiO2及少量Fe、Al、Zn的化合物等杂质。SiO2难溶于水也难溶于酸,制备过程中不参加反应。
b焙烧时发生的反应:
c锰离子在pH大于6的环境中易形成Mn(OH)2沉淀,部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |

