2NO2(g)+H2O(l)HNO3(aq)+HNO2(aq)△H=-116.1kJ·mol-1
3HNO2(aq)HNO3(aq)+2NO(g)+H2O(l)△H=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)2HNO3(aq)+NO(g)的△H=kJ·mol-1

①投料比一定时,要提高N2O平衡转化率,可采取的措施是。
②反应达到平衡前,在同温同压条件下的相同时间段内,N2O的转化率在使用催化剂2时比使用催化剂1要高,原因是。
③在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入1molN2O、4molCO和相同催化剂,发生上述反应。实验测得A、B容器中N2O的转化率随时间的变化关系如图乙所示。
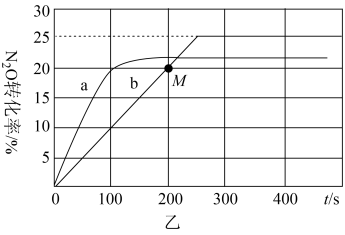
Ⅰ.曲线b中,从反应开始到M点处,用N2O表示的反应速率为mol/(L·s)。
Ⅱ.容器B中N2O的转化率随时间的变化关系是图乙中的(填“a”或“b”)曲线。

①A、B、C三点中NO2的转化率最高的是(填“A”、“B”或“C”)点,理由是。
②C点时该反应的压强平衡常数Kp=MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
微信扫码预览、分享更方便