

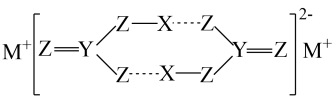


下列说法错误的是( )
实验I、25℃, 相同镁条分别与下列试剂反应
序号 | 试剂 | 浓度(mol·L-1) | 体积(mL) | pH | 现象 |
i | H2O | —— | 7.5 | 7 | 镁条表面有微量气泡附着 |
ii | NaHCO3溶液 | 1.0 | 7.5 | 8.4 | 镁条表面持续产生大量气泡,溶液略显浑浊,点燃气泡有爆鸣声 |
①Mg可以提高的电离程度,原因是;
②浑浊的主要原因是产生了(填化学式) ;
③实验ii中产生气泡的速率快于实验i的原因可能是。
序号 | 试剂 | 浓度(mol·L-1) | 体积(mL) | pH | 现象 |
iii | NaNO3溶液 | 1.0 | 7.5 | 7 | 镁条表面有微量气泡附着 |
iv | Na2CO3溶液 | 0.5 | 7.5 | 11.8 | 持续产生少量气泡,溶液显浑浊 |
①小组设计实验iii 的目的是 ; 甲同学结合实验iv的现象认为可以不必进行实验iii,他的理由是;
②实验ii生成气体的速率快于实验iv,原因可能是 ;
③查资料知+Mg2+
[Mg(HCO3)]+ , 请从平衡移动的角度解释实验ii产生气体速率更快的原因。

①CH4(g)+ H2O(g)→CO(g) + 3H2(g) ΔH1= + 206.2 kJ/mol
②CH4(g) + CO2(g)→2CO(g) + 2H2(g) ΔH2= + 247.3 kJ/mol
a.碳氢键的断裂 b.氢氧键的断裂 c.碳氧键的形成


OH*起到的作用是。



已知: (1) R-CH3 R-COOH
(2)  (R1、R2、R3和R4代表除H外的任意基团)
(R1、R2、R3和R4代表除H外的任意基团)
回答下列问题:
 的化学名称为,其最多有个原子共平面。
的化学名称为,其最多有个原子共平面。
 的水解产物为C2H5OH和;该产物具有
的水解产物为C2H5OH和;该产物具有 结构且苯环上有5个取代基的同分异构体有。种。
结构且苯环上有5个取代基的同分异构体有。种。