

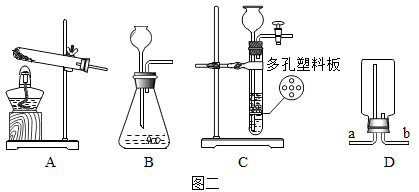
①图中用于加热试管的仪器名称是。
②诺将装置A和E连接制取气体X,A中反应的化学方程式为。
③诺用装置B和F制取气体X,装置中a和c相连,则气体X是。
【操究活动1】①将一定量的过氧化钙加入水中,缓慢产生气泡(经检验该气体能使带火星的木条复燃);
②取少量反应后的液体于试管中,滴加酚酞试液,溶液变红。据此得出反应的化学方程式为。
【探究活动2】另取①中上层清液,加入Na2CO3溶液,充分反应后有沉淀生成,生成沉淀的化学方程式为。过滤,得到滤渣和滤液。
【作出猜想】猜想一:NaOH 猜想二: 猜想三:NaOH、Na2CO3




【提出问题】泡腾片太空实验中产生的气体是什么?产生该气体的反应原理是什么?
【作出猜想】兴趣小组的同学们作出了如下猜想:
①氧气②二氧化碳③氢气④一氧化碳⑤氮气
大家一致认为作为药品,因一氧化碳有毒,应无一氧化碳。

①图2中仪器a的名称是。
②若要随时取用①或②气体,其发生装置应选用图2中的(填装置序号);用G装置干燥该气体,气体应从端(填m或n)通入,收集该气体应选用图2中的(填装置序号)。
③同学们利用上述装置收集了两瓶该气体,作如下验证实验。
检验猜想 | 实验步骤 | 实验现象 | 实验结论 | |
①或② | 将带火星的木条伸入其中一瓶中。 | 猜想①不正确 | 泡腾片放入水中产生的气体为二氧化碳。 | |
向另一瓶中注入适量的澄清石灰水,振荡。 | 猜想②正确 | |||
①泡腾片溶于水的过程中,柠檬酸(H3Ci)与碳酸氢钠反应的化学方程式。
②从图3分析H3Ci和NaHCO3反应的微观实质是。



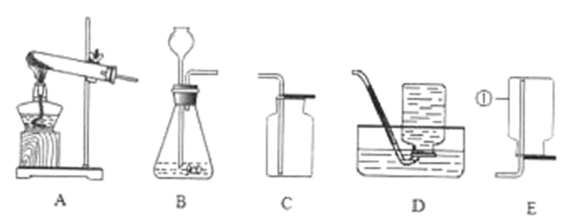

①仪器A的名称是。
②从上图中选择合适的仪器组装一套CO2发生装置,要求添加盐酸无需拆开装置,需要用到的仪器有哪些?(填标号)
序号 | 反应物 | 收集每瓶气体所用时间(单位:秒) | |||||||
盐酸 浓度 | 盐酸 体积 | 大理石 形状 | 第1瓶 | 第2瓶 | 第3瓶 | 第4瓶 | 第5瓶 | 第6瓶 | |
实验1 | 10% | 70mL | 小颗粒 | 8 | 9 | 10 | 12 | 14 | 19 |
实验2 | 块状 | 11 | 12 | 15 | 17 | 21 | 23 | ||
实验3 | 7.5% | 70mL | 小颗粒 | 10 | 12 | 13 | 15 | 17 | 26 |
实验4 | 块状 | t | 14 | 16 | 19 | 22 | 24 | ||
实验5 | 5% | 70mL | 小颗粒 | 14 | 18 | 19 | 32 | 63 | — |
实验6 | 块状 | 20 | 31 | 59 | — | — | — | ||
①该小组研究了哪些因素对反应快慢的影响?
②为了分析浓度对反应快慢的影响,可对比表中实验(填标号)。
A.2和3 B.2和4 C.4和5 D.1和6
③根据实验数据反映出的规律,表中数值t的合理范围是:<t<。
①写出制备CO2的化学方程式。
②推测废液所含溶质
推测一: 推测二:CaCl2和HCl
③若要用一种药品验证哪种推测成立,可选择的有哪些?(填标号)
A.石蕊溶液 B.AgNO3溶液 C.锌粒 D.CuO粉末
实验表明废液中的溶质是CaCl2和HCl,小组决定用Na2CO3除去它们。
【提出问题】如何估算Na2CO3固体的用量?
【进行实验】取100mL废液样品于烧杯中,逐滴滴加5.3%的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如图所示。

【结果讨论】
①a→b阶段,观察到烧杯中的现象是。
②b点后曲线平缓阶段,反应的化学方程式为。
③c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成,说明处理100mL废液,所需5.3%的Na2CO3溶液的体积120mL。(填“大于”“等于”或“小于”)
④将烧杯中的沉淀过滤、干燥、称重,质量为4g。若处理10L该废液,理论上需要Na2CO3固体g。(实验所用Na2CO3溶液的密度近似看做1g/cm3)
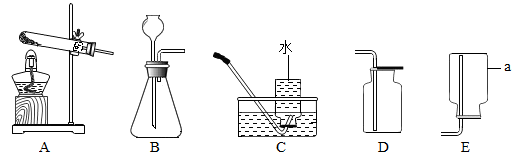
①写出仪器a的名称:。
②实验室用高锰酸钾制取并收集氧气,应选用的装置为(填序号)。
③实验室用大理石和稀盐酸制取并收集二氧化碳,应选用的装置为(填序号),反应的化学方程式为。
④做实验时,不慎碰倒酒精灯,酒精在桌面上燃烧起来,用湿抹布盖在燃烧的酒精上,火焰熄灭。火焰熄灭的原因是降低了温度和(填序号)。
A.隔绝空气 B.降低着火点 C.清除可燃物
选项 | A | B | C |
实验 |
|
|
|
实验描述 | 蜡烛由低到高依次熄灭,说明通常状况下二氧化碳不燃烧,不支持燃烧,密度比空气的大 | 烧杯中饱和石灰水变浑浊,说明氢氧化钠固体溶于水吸收热量使烧杯中溶液温度降低 | 水溶液呈紫色,汽油的颜色不变,说明同一物质在不同溶剂中溶解性不同 |
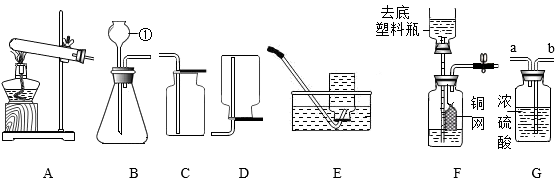

②装置C中试剂X应该选用(填字母)。
a.稀H2SO4 b.浓H2SO4 c.KOH溶液


①检验装置D中CO2已经集满的方法是。
②随着反应的进行,锥形瓶中压强降低的原因是。
③反应结束后锥形瓶中的压强保持在40kPa说明。

【查阅资料】
材料一:溶液的导电力越强,溶液的电导率越大。
材料二:单位体积溶液中某离子的个数越多,则该离子的浓度越大,溶液的导电能力越强。相同浓度的不同离子导电能力不同。
材料三:Ca(OH)2溶于水能完全解离出Ca2+和OH-。
CaCO3遇到溶有CO2的水时,能反应生成易溶于水的Ca(HCO3)2 , Ca(HCO3)2在水中能完全解离出Ca2+和;。
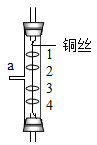
①石灰水中通入CO2气体,溶液的电导率先逐渐降低的主要原因是。
②反应最终电导率的稳定值低于初始值的可能原因是、。

a.③④①②⑤ b.④③①⑤② c.④③①②⑤ d.③④①⑤②

①关闭止水夹,打开分液漏斗活塞,缓慢滴加盐酸至不再有气泡产生,关闭分液漏斗活塞;打开止水夹,缓缓通入空气。通入空气的作用是。
②装置D的作用是。
③实验时,称取的碳酸钙产品的质量为m1g,反应后得到BaCO3的质量为m2g,则该产品中CaCO3的质量分数为(用含m1和m2的代数式表示)。

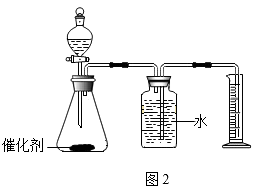
①制取H2S气体的发生装置可选用(填字母序号)。
②若用C装置来收集H2S,气体应从端(填a或b)进入集气瓶。
实验序号 | 过氧化氢溶液 | 催化剂 | 收集50mLO2所用时间 |
实验1 | 30mL2% | 粉末状MnO2 0.2g | 21s |
实验2 | 30mL2% | 粉末状CuO ag | 47s |
①表格中a的值为。
②实验1中制取氧气的化学反应方程式为。
③结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是。