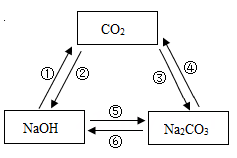
| 选项 |
实验目的 |
所用试剂或方法 |
| A |
稀释浓硫酸 |
把水倒入浓硫酸中,不断搅拌 |
| B |
鉴别NaCl溶液和稀盐酸 |
向盛有两种溶液的试管中分别滴入AgNO3溶液 |
| C |
除去NaOH溶液中的Na2CO3 |
加入适量的Ca(OH)2溶液、搅拌、过滤 |
| D |
验证Zn、Cu、Fe的金属活动性强弱 |
将铜片分别插入ZnSO4和FeSO4溶液中 |
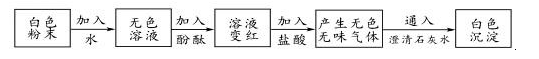
| 溶液 | 甲+乙 | 乙+丙 | 丙+丁 | 甲+丁 |
| 现象 | 无明显现象 | 白色沉淀 | 白色沉淀 | 无色气体 |
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是( )
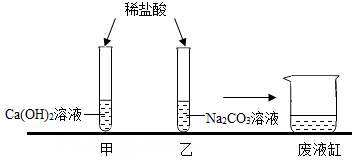
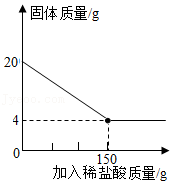
①2类 ②3类 ③4类 ④5类

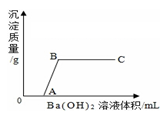
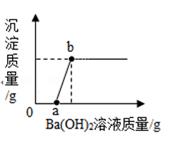
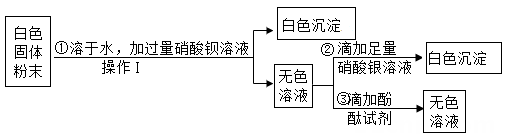

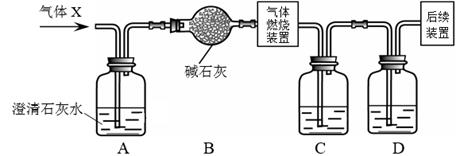
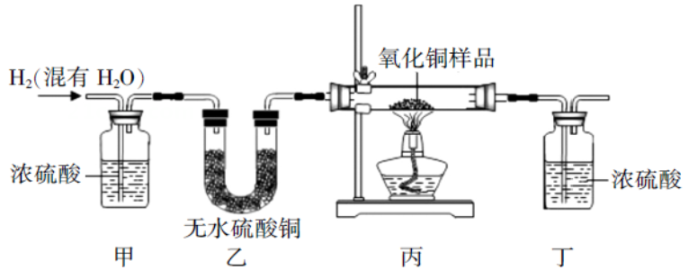
①装置C、D中盛放的试剂依次是。(填序号)
a.烧碱溶液 b.浓硫酸
②若取一定质量的气体X进行实验(假设每步反应都完全),发现装置A中无明显变化,装置C和装置D质量均增加。则气体X的组成是。
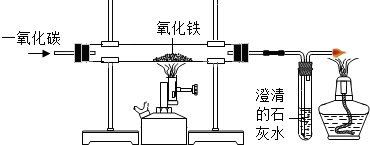
实验室可用下图装置模拟工业炼铁.