 B . 建筑材料
B . 建筑材料  C . 制肥皂
C . 制肥皂  D . 人工降雨
D . 人工降雨 






B .
B . 
C .
C . 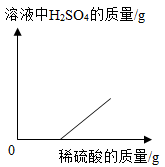
D .
D . 
| 序号 | 实验目的 | 实验方案 |
| A | 区分氢氧化钠溶液和氢氧化钙溶液 | 取样品,加入碳酸钠溶液 |
| B | 用pH试纸测定溶液的酸碱性 | 将pH试纸进入待测液体 |
| C | 探究稀盐酸和氢氧化钠溶液是否完全反应 | 向反应后溶液中加入硝酸银溶液 |
| D | 除去氢氧化钠溶液中的碳酸钠 | 滴加稀盐酸,直到刚好无气泡产生 |






①酸雨的酸性比正常雨水的酸性(填“强”或“弱”)。
②测量苹果汁pH时,先用蒸馏水润湿pH试纸,会使pH偏(“大”或“小”)。

流程II为粗盐精制。粗盐中通常含有泥沙等难溶性杂质和Ca2+、Mg2+、等可溶性杂质离子。为除去上述可溶性杂质离子,将粗盐溶解并依次加入下列试剂:过量氢氧化钠溶液→过量氯化钡溶液→过量的Na2CO3溶液→过滤→适量稀盐酸。有同学认为,用一种试剂代替氢氧化钠和氯化钡两种试剂也能达成实验目的,该试剂是 。
流程III为海水“制碱”。滤液A中碳酸氢钠是否饱和? (填“是”或“否”)。
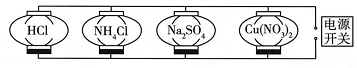
电源开关处的物质是(填化学式),Na2SO4 , 处对应的现象是。

【查阅资料】CaCl2溶液呈中性。
【提出问题】废液中的溶质是什么物质?
【作出猜想】猜想一:废液中的溶质只有CaCl2.
猜想二:废液中的溶质有CaCl2和(填化学式)。
【实验与结论】①甲同学取少量CaCl2溶液和废液分别加入2支试管中,并向其中分别滴加无色酚酞溶液做对比实验,结果两试管中溶液均无色,于是甲同学认为猜想一是正确的。
②你认为甲同学的实验(填“能”或“不能”)证明猜想一是正确的,理由是
【查阅资料】在饱和碳酸氢钠溶液中几乎不溶解
【提出问题1】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究1】小科同学设计了如图1所示装置(铁架台略去),实验在27℃,下进行。小科的实验中会有
残留在试管
中,对实验结果是否有影响并说明理
【提出问题2】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究2】为得到纯净的氢氧化钠固体,小思设计了如图2所示的实验流程。实验最终氢氧化钠固体质量变质后样品中氢氧化钠的质量(填:“小于”、“等于”或“大于”)。

【实验反思】通过本实验,你学会了定量测定变质样品中某成分的含量以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考的问题有(填序号)
①选择试剂种类;②确定试剂用量;③试剂产地;④实验装置与实验步骤的设计;⑤实验安全环保;⑥测量中减少误差
探究1:生成沉淀颜色与反应物的质量比的关系
两种溶液取用的质量及实验现象如表所示(两种溶液混合后充分振荡试管);
| 编号 | 4%的NaOH溶液的质量/g | 8%的CuSO4溶液的质量/g | 沉淀颜色 | 出现黑色物质所等待的时间/min |
| ① | 2 | 2 | 浅绿色 | 不出现 |
| ② | 4 | 待填 | 蓝色中混有浅绿色 | 5 |
| ③ | 6 | 2 | 蓝色 | 3 |
按探究1中③的方法制备5份含蓝色沉淀的混合物,处理方式和实验结果如表所示:
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 处理方式 | 不做处理 | 直接向试管中加8mL水 | 直接向试管中加16mL水 | 滤出蓝色沉淀,洗涤至中性后放入洁净试管,加8mL水 | 滤出蓝色沉淀,洗涤至中性后放入洁净试管,加8mL4%的Na2SO4溶液 |
| 出现黑色物质所等待的时间/min | 3 | 11 | 17 | 不出现 | 不出现 |
判断④中的蓝色沉淀已洗涤至中性的操作是。

①装置C、D中盛放的试剂依次是。(填序号)
a.烧碱溶液b.浓硫酸
②若取一定质量的气体X进行实验(假设每步反应都完全),发现装置A中无明显变化,装置C和装置D质量均增加。则气体X的组成是。


查阅资料:I、H2S能与NaOH等碱溶液、CuSO4溶液反应。Ⅱ、CO2中混有的HC1气体可用饱和NaHCO3溶液吸收。

|
盐酸利用率与盐酸溶质质量分数的关系 |
|||
|
组别 |
A |
B |
C |
|
盐酸溶质质量分数 |
7.3% |
14.6% |
21.9% |
|
盐酸利用率 |
82.5% |
81.5% |
72.1% |



| 实验次数 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入稀盐酸的质量(g) | 25 | 25 | 25 | 25 | 25 | 25 |
| 电子天平的示数(g) | 125 | 150 | 175 | 199.7 | M | 248.9 |