
选项 | 探究方案及现象 | 探究目的 |
A | 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 | 醋酸是弱电解质 |
B | 向久置的 |
|
C | 向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色 | 氧化性: |
D | 向盛有 |
|


已知75℃时,在碱性条件下会转化为
和
, 室温下
的溶解度远小于KCl。下列说法正确的是( )


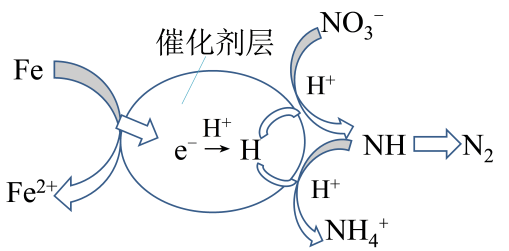
阴极上发生反应:、
阴极区溶液中发生反应:、
以恒定电流进行电解,测得阴极区溶液中部分离子的物质的量浓度随时间变化如图-2所示。下列说法错误的是( )
![]()
①烟气中的硒元素能转变为单质硒的原因是。
②烟气中含有少量相对分子质量为224的硒氧化物,该氧化物的分子式为。

①溶解0.1molAgCl(s),至少需加入氨水的体积为(忽略溶液体积的变化)。
②水合肼还原[Ag(NH3)2]Cl的化学方程式为。

已知:①HR为酸性磷类有机萃取剂,难溶于水,可萃取Fe3+ , 萃取时发生反应:Fe3++3HR⇌FeR3+3H+ , 生成的FeR3可溶解在HR中。
②Li2CO3、LiHCO3的溶解度如图1所示:




已知:ⅰ)在水中,ZVI表面的FeOH会因为质子化/去质子化作用而使其表面带正/负电荷,可表示为:FeOH+H+FeOH
, FeOH
FeO-+H+。pH约为8.1达到等电点,ZVI表面不带电。
ⅱ)pH<6时,ZVI去除Pb2+主要发生表面配位反应和还原反应:
2FeOH+ Pb2+
(FeO)2Pb + 4H+
2Fe+ 3Pb2++ 4H2O3Pb+2FeOOH + 6H+
①pH<6时,铁氧化物颗粒不易吸附Pb2+的原因是。
②pH<6时,随着pH增大,Pb2+的去除率会增大至接近100%的原因是。
① 称取一定量的Na2SO3于烧杯中,溶于水。
② ②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③ 如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④ 滤液在经过相关实验操作后析出Na2S2O3·5H2O晶体。
⑤ 进行减压过滤并低温干燥。
(图1是有关物质的溶解度曲线)

