 C . 乙烯的结构简式是
C . 乙烯的结构简式是①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为( )

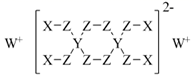
选项 | 实验操作 | 实验目的 |
A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色查化 | 证明二氧化硫具有漂白性 |
B | 向2mL1mol·L-1NaOH溶液中先加入3滴1mol·L-1 FeCl3溶液.再加入3滴1mol·L-1MgCl2溶液 | 证明 Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
C | 相同温度下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2 分解速率的影响 |
D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴含NaClO的“84”消毒液,观察红色褪色快慢 | 证明随溶液ph减小,“84”消毒液的氧化能力增强 |



已知:Ga2O3与Al2O3性质相似,能与NaOH反应生成可溶性盐NaGaO2。


已知:
①钒铬渣中含有 , 及
等;
②时,
的溶度积常数为
;
。
回答下列问题:


部分物质的相关性质如表所示:
物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
常温性状 | 白色片状或针状晶体 | 无色液体 | 无色液体 |
沸点/℃ | 249 | 78 | 213 |
相对分子质量 | 122 | 46 | 150 |
溶解性 | 微溶于水,溶于乙醇、乙醚等 | 与水以任意比互溶 | 难溶于冷水,微溶于热水,溶于乙醇和乙醚等 |
回答下列问题:


已知:对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可表示平衡常数(Kp)。(的物质的量分数,
为平衡时气体总压强)。
温度升高时,混合气体的平均摩尔质量(填“增大”“减小”或“不变”)。温度为T4℃时,该反应的平衡常数=MPa(用含a的代数式表示)。
a.
| b.
|
c.
| d.
|
①机理a的中间体为。
②已知 ,
为正反应速率,k为速率常数,上述机理中与该速率方程一致的是(填字母)。

①a极的电极反应式为。
②电池工作时,H+经质子膜进入区(填“a极”或“b极”)。

①原子坐标参数A为( ,
,
),则B、C的原子坐标参数分别为、
②已知Cd、Se的半径分别为anm和bnm,则CdSe的密度为g·cm-3(列出计算表达式,NA表示阿伏加德罗常数的值)。
①含有基团![]() 、环上有三个取代基②与NaHCO3反应产生气泡 ③可发生缩聚反应,M的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同是。
、环上有三个取代基②与NaHCO3反应产生气泡 ③可发生缩聚反应,M的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同是。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪