常见古诗文记载 | 化学知识 | |
A | 《泉州府志》:元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。 | 泥土具有吸附作用,能将红糖变白糖 |
B | 《荀子·劝学》:冰水为之,而寒于水。 | 冰的能量低于水,冰变为水属于吸热反应 |
C | 《本草纲目》:采蒿蓼之属,晒干烧灰,以原水淋汁,久则凝淀如石(石碱),浣衣发面。 | 石碱具有碱性,遇酸产生气体 |
D | 《天工开物》:凡研硝(KNO3)不以铁碾入石臼,相激火生,祸不可测。 | 性质不稳定,撞击易爆炸 |
 D . 离子结构示意图
D . 离子结构示意图选项 | 实 验 | 实验结论或解释 |
A | 向2mL 0.1mol/L FeCl3溶液中滴加0.1mol/L KI溶液5~6滴,充分反应后,再滴加几滴0.01mol/L KSCN溶液,出现血红色溶液。 | Fe3+与I-之间的反应属于可逆反应 |
B | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度 | 则测得的反应速率偏高 |
C | 分别向装有2mL 0.1mol/L H2C2O4溶液和2mL 0.2mol/L H2C2O4溶液的两支试管中加入4mL 0.01mol/L酸性KMnO4溶液,振荡,后者溶液先褪色。 | 探究浓度对反应速率的影响 |
D | 将石灰石与盐酸反应产生的气体直接通入水玻璃中,生成白色沉淀 | 非金属性: C >Si |
实验 | c(NO)/mol·L-1 | c(H2)/mol·L-1 | v(正)/mol·L-1·min-1 |
① | 0.10 | 0.10 | 0.414k |
② | 0.10 | 0.40 | 1.656k |
③ | 0.20 | 0.10 | 1.656k |
下列有关推断正确的是( )
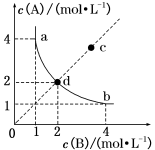


注:CuS既不溶于稀硫酸,也不与稀硫酸反应


主要副反应:(Ⅱ)H2(g)+CO2(g) CO(g)+H2O(g);ΔH2>0,
(Ⅲ)4H2(g)+CO2(g) CH4(g)+2H2O(g);ΔH3<0。
在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法正确的是( )

①CaBr2+H2O CaO+2HBr ②2HBr+Hg
HgBr2+H2
③HgBr2+__ +_ ④2HgO2
Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:HgBr2+__+_。
请根据“绿色化学”的思想评估该方法制H2的主要缺点:。
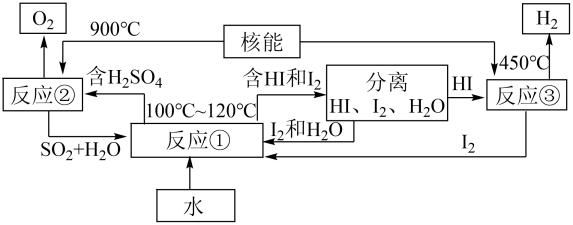
请写出化学方程式:
反应①。反应②。
若升高温度到950℃时,达到平衡时K1(填“>”“<”或“=”)
①当x=5.0时,上述平衡向(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
a.使用一定量P2O4萃取时应该将萃取剂分多次萃取,萃取效率更高
b.分液漏斗使用前一定要检验是否漏液
c.振荡过程中,需要打开活塞放气
d.萃取后分液时需要先旋开活塞,再打开上端玻璃塞

将氯气和空气(不参与反应)按体积比1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
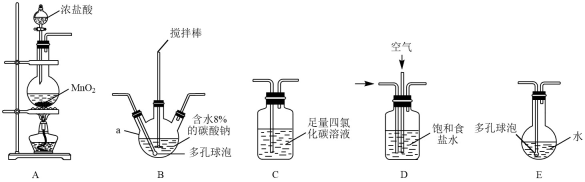
各装置的连接顺序为→→→C→;(填字母)
已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.8 mol/L的FeSO4溶液,充分反应后,用0.05000 mol/L的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸的物质的量浓度为。(保留四位有效数字)