实验 | 操作 | |
A | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
B | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
C | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |

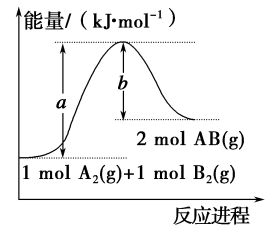

①液态水汽化②将胆矾加热变为白色粉末③浓H2SO4稀释④KClO3分解制O2 ⑤生石灰跟水反应生成熟石灰⑥CaCO3高温分解⑦CO2+C2CO ⑧Ba(OH)2·8H2O与固体NH4Cl混合⑨C+H2O(g)
CO+H2⑩Al与盐酸反应



①一定条件下L的转化率 ②混合气体中M的百分含量
③混合气体中L的百分含量 ④混合气体的平均摩尔质量
 1,3,4-三甲苯
C .
1,3,4-三甲苯
C .  2-乙基-1-丁烯
D .
2-乙基-1-丁烯
D . 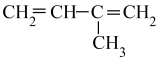 2-甲基-1,3-二丁烯
2-甲基-1,3-二丁烯


①加入硝酸银溶液 ②加入氢氧化钠溶液 ③加热 ④加入稀硝酸至溶液呈酸性

①该化合物属于芳香烃
②分子中至少有7个碳原子处于同一平面
③该化合物可以发生取代反应、加成反应、加聚反应、氧化反应
④1 mol该化合物最多可与4 mol Br2发生加成反应
营养成分表 | ||
项目 | 每100毫升 | 营养素参考值% |
能量 | 190千焦 | 2% |
蛋白质 | 0克 | 0% |
脂肪 | 0克 | 0% |
-饱和脂肪酸 | 0克 | 0% |
碳水化合物 | 11.2克 | 4% |
-糖 | 11.2克 | |
钠 | 12毫克 | 1% |

按要求回答下列问题。
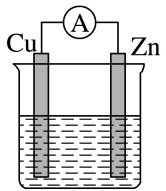
②装置D和E中出现的不同现象说明的问题是。
③装置F的作用是。
④写出装置G中发生反应的离子方程式。

N2(g) + O2(g) = 2NO(g) ∆H2= b kJ/mol
2NO(g) + 2CO(g) =2CO2(g) + N2(g) ∆H3= c kJ/mol
则 2NO(g) + C(s) = CO2(g) + N2(g) ∆H=kJ/mol
已知2NO(g)+2CO(g)N2(g)+2CO2(g) ∆H<0。
①在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是。
A.(CO)正 = 2
(N2)逆
B.体系中混合气体密度不变
C.混合气体的平均相对分子质量不变
D.体系中NO、CO的浓度相等
E.单位时间内消耗nmol的NO同时消耗nmol的N2
②向1L密闭容器中通入1mol的NO和1mol的CO气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:

T1T2(填“>”、“<”),理由是。M点时混合气体中CO的体积分数为。
③一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如表所示:
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
p/kPa | 200 | 185 | 173 | 165 | 160 | 160 |
该反应条件下的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),该反应中的正=k正·p2(NO)p2(CO),
逆=k逆·p(N2)p2(CO2),则该反应达到平衡时,k正k逆(填“>”、“<”或“=”)。
①苯环上有氨基(-NH2) ②能发生银镜反应