 B . 其他垃圾
B . 其他垃圾  C . 有害垃圾
C . 有害垃圾  D . 厨余垃圾
D . 厨余垃圾 
 B . 配制NaOH溶液
B . 配制NaOH溶液 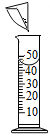 C . 稀释浓H2SO4
C . 稀释浓H2SO4  D . 测稀H2SO4的pH
D . 测稀H2SO4的pH 

| 选项 | 物质 | 杂质 | 方案 |
| A | Cu粉 | Zn粉 | 加入足量CuCl2溶液后过滤、洗涤、干燥 |
| B | CO气体 | CO2气体 | 通过足量的氢氧化钠溶液后干燥 |
| C | NaCl固体 | Na2CO3固体 | 加入足量的稀盐酸后蒸发 |
| D | BaCO3固体 | BaCl2固体 | 加水溶解再通入足量的二氧化碳后蒸发 |
 B .
B .  C .
C . 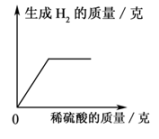 D .
D . 
 B .
B . 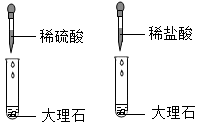 C .
C . 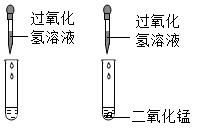 D .
D . 

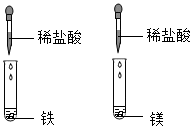
 向等质量的铝粉和镁粉中分别滴入质量分数相同的足量的稀盐酸
B .
向等质量的铝粉和镁粉中分别滴入质量分数相同的足量的稀盐酸
B .  等质量的块状石灰石和粉末状石灰石分别与质量分数相同的足量的稀盐酸反应
C .
等质量的块状石灰石和粉末状石灰石分别与质量分数相同的足量的稀盐酸反应
C .  向一定量的氢氧化钡溶液中不断加入稀硫酸
D .
向一定量的氢氧化钡溶液中不断加入稀硫酸
D .  一定量的氢氧化钠溶液中,通入二氧化碳,至恰好完全反应
一定量的氢氧化钠溶液中,通入二氧化碳,至恰好完全反应




①利用原装置,将KOH溶液换成水做对比实验,观察现象
②在原实验后的试管中继续滴加CaCl2溶液,观察现象
③在原实验后的试管中继续滴加酚酞溶液,观察现象
A.NaOH、BaCl2、Na2CO3 B.Ba(NO3)2、Na2CO3、NaOH
C.Na2CO3、BaCl2、NaOH D.BaCl2、NaOH、Na2CO3
①铜、银、硫酸亚铁溶液 ②铁、银、硫酸铜溶液
③铁、铜、银、稀硫酸 ④铜、硫酸亚铁溶液,硝酸银溶液

Ⅰ.取少量体于烧杯中,加足量的水溶解,烧杯内有固体残留并得到无色溶液;
Ⅱ.往烧杯中加入足量的稀盐酸并搅拌,发现有气体生成,杯底仍有固体剩余,并得到上层清液A;
Ⅲ.继续往Ⅱ中烧杯的所得物质中逐滴滴加碳酸钠溶液并搅拌,烧杯内固体的质量随加入碳酸钠质量的变化如图所示。

根据上述实验过程和发生的现象,请你回答下列问题
【实验操作】取一块状石灰石于试管中,往试管中加入5毫升稀盐酸。
【实验现象】①开始时固体表面有大量气泡;②反应停止后,试管底部有块状固体残留、固体表面无气泡;③试管内溶液无色。

【继续探究】对原残留液体是否还有盐酸的探究,有同学取原残留液体,滴加AgNO3溶液,产生白色沉淀,再滴加稀硝酸沉淀不溶解。于是根据这一现象,得出了原残留液体中存在盐酸的结论。但小金认为根据这一现象是不能得出原残留液中存在盐酸的结论,小金的理由是。
【实验结论】在原反应结束时,稀盐酸与石灰石没有恰好完全反应,石灰石中碳酸钙有剩余。

实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色。于是,同学们将废液进行过滤,并对过滤所得滤液中所含溶质成分进行进一步的探究。
【假设猜想】通过分析上述实验,小科猜想:滤液中除酚酞外一定含有氯化钠和氢氧化钠,你认为他的猜想合理吗?请说明理由。


|
装置序号 |
C |
D |
G+H |
|
反应前质量(g) |
a |
b |
c |
|
反应后质量(g) |
d |
e |
f |

①实验中,小金在加热前先通一段时间的混合气体,其目的是;
②试验前后 C(硬质玻璃管和样品的总质量)、D、G+H 的质量如表变化,若(选用表格中的字母,列数学表达式),说明该混合气体中含有 CO。
【实验目的】确定白色固体的组成
【实验方案】

【实验结论】该白色固体由NaHCO3和NaCl两种物质组成。
a. 基于上述实验结论,则步骤①中加入的过量稀酸应该是。
b.写出步骤②中生成白色沉淀的化学方程式:。
【实验目的】测定该白色固体中NaHCO3的质量分数。
为了测定该样品中NaHCO3的质量分数,小吕取a g该样品,设计了如下方案:
方案:利用NaHCO3与稀硫酸反应产生CO2 , 通过测定生成CO2的质量,计算样品中NaHCO3的质量分数。
a.小吕用下列装置完成本实验,装置的连接顺序是(填装置的字母编号)。

b.装置D中的反应完全后,需再次通入空气,其目的是。
|
反应前 |
反应后 |
||
|
实验数据 |
石灰石样品的质量 |
加入稀盐酸的质量 |
剩余物质的质量 |
|
15g |
100g |
110.6g |
|


|
烧杯1 |
烧杯2 |
烧杯3 |
|
|
样品溶液(克) |
10 |
20 |
30 |
|
氯化钙溶液(克) |
30 |
30 |
30 |
|
沉淀质量(克) |
2 |
4 |
5 |
①如表所示,哪几个烧杯内样品中的纯碱完全反应?
②请计算样品中碳酸钠的质量分数?
