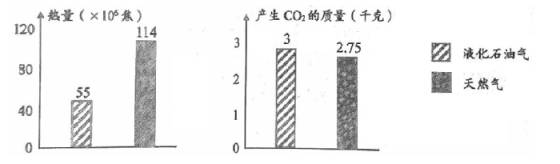
B . 切割玻璃
B . 切割玻璃 C . 树叶变黄
C . 树叶变黄 D . 灯泡通电发光
D . 灯泡通电发光
 B . 稀释浓硫酸
B . 稀释浓硫酸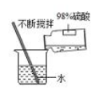 C . 称量氢氧化钠固体
C . 称量氢氧化钠固体 D . 测定土壤溶液酸碱性
D . 测定土壤溶液酸碱性
|
血浆 |
唾液 |
胃液 |
胆汁 |
胰液 |
|
7.35~7.45 |
6.6~7.1 |
0.9~1.5 |
7.1~7.3 |
7.5~8.0 |
①Zn+ H2SO4=ZnSO4+H2↑
②ZnO+H2SO4=ZnSO4+H2O
③Zn(OH)2+H2SO4=ZnSO4+2H2O
④ZnCO3+H2SO4=ZnSO4+ H2O+CO2↑

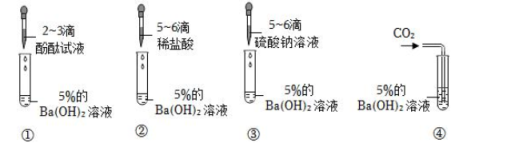
| 加入物质 | 稀盐酸 | 氯化钡溶液 | 氯化钠溶液 |
| 实验现象 | 固体溶解,产生气体 | 产生白色沉淀 | 固体溶解 |
|
氧化钾 |
氧化钙 |
氧化钠 |
氧化镁 |
氧化铝 |
氧化锌 |
氧化铁 |
氧化铜 |
|
K2O |
CaO |
Na2O |
MgO |
Al2O3 |
ZnO |
|
CuO |
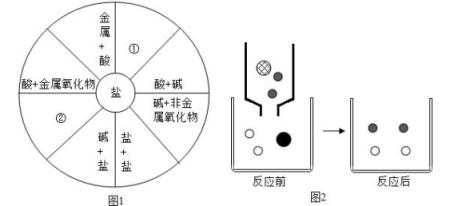
①元素化合价 ②活动性顺序 ③原子的相对原子质量

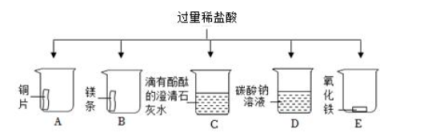
|
实验操作 |
实验现象 |
实验结论 |
|
取少量反应后的溶液于试管中,加入 |
|
两种物质恰好完全反应 |

4MO2+2CO2=2M2CO3+3O2

【猜想与假设】猜想1:白色固体是Ca(OH)2

猜想2:白色固体是CaCO3猜想3:白色固体是
【实验探究】同学们设计了不同的方法验证猜想。
甲同学:取少量样品加水,充分振荡,发现溶液中大量固体不溶解,则证明CaCO3的存在。
乙同学:取少量样品加水,充分振荡,静置后加入无色酚酞试液,试液变红,证明Ca(OH)2的存在。丙同学:取少量样品加入足量稀盐酸,观察到气泡产生,证明CaCO3存在。
请指出以上方法中不合理的是哪位同学,并说明理由。
【进一步探究】丁同学取1克样品与足量的稀盐酸反应,实验装置如图1所示,测量生成气体的体积(气体不溶于植物油)如图2所示。已知在该实验条件下,生成气体的密度为2g/L,计算样品中Ca(OH)2的质量分数为。
【查阅资料】①FeCO3在空气中灼烧生成一种铁的氧化物和二氧化碳。
②FeO是一种黑色粉末,在空气中加热,能迅速被氧化成四氧化三铁,Fe2O3能与盐酸反应生成FeCl3和水,Fe3O4能与盐酸反应生成FeCl2、FeCl3和水。
③FeCl2能使酸性高锰酸钾溶液褪色,向FeCl3溶液中滴加KSCN(硫氰化钾)溶液,溶液变红色。
【猜想与假设】猜想1:固体成分是Fe2O3;
猜想2:固体成分是Fe3O4;
猜想3:固体成分是FeO。
|
实验编号 |
实验步骤 |
实验现象 |
|
a |
向甲溶液中滴加 KSCN溶液 |
溶液变红色 |
|
b |
向乙溶液中滴加酸性高锰酸钾溶液 |
高锰酸钾溶液的紫红色不消失 |
【解释与结论】由实验a、b的现象可知,(填“猜想1”或“猜想2”〉成立。
|
实验编号 |
氯化镁溶液浓度/(gL/-1) |
反应温度/℃ |
Mg(OH)2转化率/% |
|
A |
20 |
30 |
27.06 |
|
B |
40 |
30 |
56.77 |
|
C |
40 |
40 |
69.64 |
|
D |
40 |
60 |
54.30 |
|
E |
60 |
60 |
50.60 |
小明为探究疏通剂的用量与喷溅的关系,买了一款管道疏通剂。疏通剂的主要成分为:苛性钠(氢氧化钠)、铝粒、抗金属腐蚀剂、色料等。小明同学请教了老师,老师告诉他疏通剂的原理为氢氧化钠和铝遇到水会发生剧烈的反应,同时放出大量的热量,化学方程式为:
2NaOH+2Al+2H2O=2NaAlO2(偏铝酸钠)+3H2↑。氢气的产生对管道的疏通起到至关重要的作用。

小明同学在老师的帮助下,利用如图装置(夹持装置略去)进行实验探究。(缓冲瓶的作用是防止液体喷溅到后续装置中,实验中要做好必要的防护措施)
老师对实验的建议:①每次实验加15毫升常温水,疏通剂不超过25克。②实验应设计3-4组。
①检查装置的气密性。
………


资料一:暖宝宝使用双层包装。外层是常规不透气外袋,内层是由微孔透气膜制成的无纺布袋,里面装有发热材料。
资料二:暖宝宝发热材料主要是铁粉、活性炭、蛭石、水、食盐等。蛭石薄膜状,是当今世界首屈一指的超级保温材料。活性炭有强吸附性,它的疏松结构中储有水蒸气。
资料三:日常生活中,铁质物品在盐溶液中更容易生锈。
注意事项:⒈暖宝宝须妥善保存,避免外袋破损。
⒉不可将暖宝宝直接贴于皮肤表面。
综合上述信息并运用所学知识,解释暖宝宝发热的工作原理,及注意事项。

|
时间/分 |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
|
C增加质量/g |
0 |
3.0 |
5.0 |
6.0 |
6.6 |
x |
6.6 |
|
实验次数 |
加入稀硫酸的质量(g)充分 |
反应后剩余固体的质量(g) |
|
第1次 |
40 |
M |
|
第次 |
40 |
14.8 |
|
第3次 |
40 |
12.2 |
|
第4次 |
40 |
11.2 |
|
第5次 |
40 |
11.2 |
试回答下列问题: