A | B | C | D |
|
|
|
|
风力发电 | 水果电池 | 燃料燃烧 | 手机充电 |
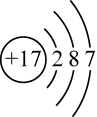 B . 水的电子式:
B . 水的电子式: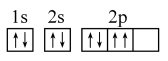
A | B | C | D |
NaCl溶于水 |
电解 |
温度对化学平衡移动的影响 |
|

A | B | C | D | |
实验目的 | 测定锌与稀硫酸反应速率 | 测定中和反应的反应热 | 比较AgCl和Ag2S溶解度大小 | 探究铁的析氢腐蚀 |
实验装置 |
|
|
|
|
容器 | 温度/℃ | 起始时物质的浓度/(mol•L-1) | 10分钟时物质的浓/(mol•L-1) | |
c(X) | c(Y) | c(Z) | ||
甲 | 400 | 1 | 1 | 0.5 |
乙 | T1 | 1 | 1 | 0.4 |
丙 | 400 | 1 | 2 | a |
下列说法中,错误的是( )
| 实验序号 | X电极材料 | 现象 |
Ⅰ | 铂(Pt) | 两极均有气泡产生,澄清石灰水不变浑浊 | |
Ⅱ | 石墨 | 两极均有气泡产生,澄清石灰水变浑浊 |
下列说法中,错误的是( )
a.球形 b.哑铃形
①CH3COOH的电离方程式是。
②该溶液中由水电离出的H+浓度是mol•L-1。
③计算CH3COOH的电离平衡常数Ka=。
化学式 | H2CO3 | HClO |
电离平衡常数(Ka) | Ka1=4.5×10–7 Ka2=4.7×10–11 | 4.0×10–8 |
①相同物质的量浓度的Na2CO3、NaHCO3、NaClO溶液,pH由小到大的顺序是。
②0.01mol•L-1NaHCO3的溶液中c(H2CO3)>c(CO),结合化学用语解释其原因:。
③NaClO溶液的漂白性与溶液中c(HClO)有关。向NaClO溶液中加入下列物质,能增大c(HClO)的是(填字母)。
a.CH3COOH b.CO2 c.Na2CO3

①电解饱和食盐水的化学方程式是。
②电极a接电源的(填“正”或“负”)极。
③离子交换膜主要允许(填离子符号)通过。

①生成锂单质的电极反应式是。
②理论分析,阳极电解产物可能有O2、Cl2。
i.生成O2的电极反应式是。
ii.实验室模拟上述过程,气体中未检测到Cl2 , 推测可能是Cl2溶于水。写出Cl2与水反应的化学方程式。
iii.取实验后阳极区溶液进行检验,证实了阳极Cl-放电。实验所用的试剂及现象是。
可选试剂:AgNO3溶液、KI溶液、淀粉溶液、品红溶液

已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ•mol-1
CH4(g)+2O2(g)=2H2O(g)+CO2(g) ΔH=-802.3kJ•mol-1
反应A的ΔH=kJ•mol-1。

①理论上,能提高CO2平衡转化率的措施有(写出一条即可)。
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2的转化效率,原因是。
a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用Na2O2作供氧剂的原因可能是Na2O2不易实现循环利用
①将等物质的量浓度、等体积的H2C2O4溶液与KOH溶液混合,反应的离子方程式是。
②向①中继续加入KOH溶液至恰好完全反应,得到K2C2O4溶液。下列关系正确的是(填字母)。
a.c(K+)>c(C2O)>c(OH-)>c(H+)
b.c(H+)+c(K+)=c(OH-)+c(HC2O)+c(C2O
)
c.c(K+)=2[c(C2O)+c(HC2O
)+c(H2C2O4)]
资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体
Fe3++3C2O[Fe(C2O4)3]3- K=1.6×1020
①取少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,继续加入硫酸,溶液变红。用平衡移动原理解释溶液变红的原因是。
②经检验反应后的溶液中无Fe2+ , 从反应原理的角度解释C2O和Fe3+未发生氧化还原反应的可能原因是。
③某同学利用如图所示装置比较Fe2+和C2O的还原性强弱。

i.闭合K,电流计指针偏转,一段时间后,取左侧溶液,(填操作和现象),证实C2O的还原性强于Fe2+。
ii.该装置的优点是。

资料:Mn2+生成Mn(OH)2 , 开始沉淀时pH=8.2,完全沉淀时pH=10.2
①上述矿石溶解过程中,能够加快化学反应速率的措施有(写出一条即可)。
②CoO溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括H+、Mn2+和。
③已知pH=2.8时溶液中Fe3+完全沉淀。沉淀2是。
④溶液2中含有Co2+和Mn2+。
i.已知:25℃时Ksp[Co(OH)2]≈1×10-15 , 当c(Co2+)<1×10-5mol•L-1时可认为Co2+完全沉淀。若向溶液2中加入碱溶液,常温下,当pH=时Co2+完全沉淀。由此可知,通过调节pH无法将Mn2+和Co2+完全分离。
ii.溶液2中加入氨水和H2O2溶液的目的是。
资料:i.M(CoCl2•6H2O)=238g•mol-1
ii.Co2+与SCN-反应生成蓝色的Co(SCN);Co2+与EDTA以物质的量比1:1反应,得到红色溶液;后者的反应程度大于前者取mg产品溶于水,向其中滴加几滴KSCN溶液作指示剂。再用cmol•L-1EDTA溶液滴定,消耗EDTA溶液的体积为vmL。滴定终点时的现象是,产品中CoCl2•6H2O的质量分数为(结果用m、v、c表示)。