物质 | H2 | Cl2 | HCl |
1mol分子中的化学键断裂时吸收的能量/kJ | 436 | a | 431 |
下列说法正确的是( )
0 | 600 | 1200 | 1710 | 2220 | 2820 | x | |
1.40 | 0.96 | 0.66 | 0.48 | 0.35 | 0.24 | 0.12 |
下列说法错误的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向 | 溶液变红,加入 | 加入 |
B | 用 |
| |
C | 向2支试管中依次加入等体积等物质的量浓度的 | 置于热水中的混合溶液先出现浑浊 | 温度升高,化学反应速率加快 |
D | 向盛有 | 观察到先产生砖红色沉淀 |
实验 | 实验操作和现象 |
1 | 用pH试纸测定0.1 mol·L-1 Na2S溶液的pH,测得pH约为l3 |
2 | 向0.1 mol·L-1 Na2S溶液中加入过量的0.2mol·L-1AgNO3溶液,产生黑色沉淀 |
3 | 向0.1 mol·L-1 Na2S溶液中通入过量的H2S气体,测得溶液pH约为9 |
4 | 向0.1mol·L-1 Na2S溶液中滴加几滴0.05mol·L-1盐酸,观察不到明显现象 |
下列说法错误的是( )
①
②
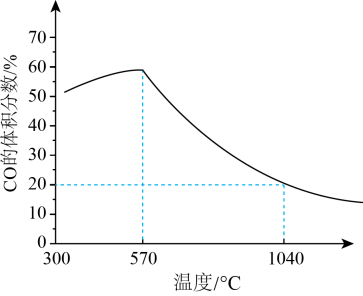
反应的还原产物与温度密切相关。其他条件一定,(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法错误的是( )
化学反应 | K(298K)的数值 |
N2(g)+O2(g) | 5.0×10-31 |
N2(g)+3H2(g) | 4.1×106 |
温度/℃ | 压强/MPa | 氨的平衡含量(体积分数) |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
①合成氨反应为(填“吸热”或“放热”)反应。
②其他条件不变时,升高温度,氨的平衡含量减小的原因是(填标号)。
A.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
B.升高温度,浓度商(Q)增大,平衡常数(K)不变,Q>K,平衡向逆反应方向移动
C.升高温度,活化分子数增多,反应速率加快
D.升高温度,平衡常数(K)减小,平衡向逆反应方向移动


则(用含a、b的式子表示)。

将一定体积含有的空气匀速通入
溶液中,反应相同时间,初始
浓度
及其
与
脱除率的关系如图乙所示。当
时,
脱除率下降的原因是。

化学方程式 | 水蒸气的平衡压强 | |
Ⅰ: | 1.04 | 6.05 |
Ⅱ: | 0.75 | 4.00 |
Ⅲ: | 0.11 | 0.60 |
①图丙表示水蒸气平衡压强与温度的关系曲线,其中表示平衡时反应Ⅲ的曲线是(填“a”“b”或“c”)。

②设为相对压力平衡常数,其表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
)除以
。在
时,反应Ⅱ的
。
①为了确定滴定终点,还需要加入的试剂为。达到滴定终点的现象为。
②在滴定实验过程中,下列仪器中有蒸馏水,对实验结果没有影响的是(填标号)。
A.酸式滴定管 B.锥形瓶 C.碱式滴定管
③经3次平行实验,达到滴定终点时,平均消耗标准溶液
, 则溶液①稀释后的精确浓度为
。


①电池的负极是电极(填“a”或“b”),该极的电极反应为。
②电池工作一段时间后,电解质溶液的(填“增大”“减小”或“不变”)。
①正极反应式为。
②总反应式为。
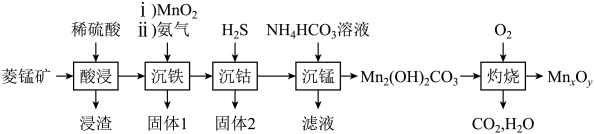
已知:常温下,。
的电离常数:
。
回答下列问题: