 D . 坩埚钳
D . 坩埚钳
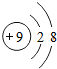 B .
B .  C .
C . 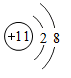 D .
D . 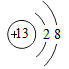
选项 | 事实 | 解释 |
A | 墙内开花墙外香 | 分子在不断运动 |
B | 水银温度计测量体温 | 温度升高,汞原子体积变大 |
C | 金刚石和石墨的物理性质不同 | 碳原子的排列方式不同 |
D | H2O和H2O2的化学性质不同 | 两种物质的分子结构不同 |


 B .
B .  C .
C .  D .
D . 

①汞元素。
②铁离子。
③2个过氧化氢分子。
④常温下某气体化合物的一个分子由3个原子构成,该气体化合物可以是。
a.3Cl2 b.SO3 c.Al3+ d.3K

①图中粒子属于金属元素的有种(填数字):
②氟和氯两种元素的原子相同,所以它们具有相似的化学性质;
③由钠和氯两种元素组成化合物的化学式为。

根据图示写出该反应的符号反应式。



①检查图1装置的气密性:往管B中加适量水,塞紧管A上端的橡胶塞,调整管B的高度,使管B内液面高于另一侧液面,过一段时间,当观察到两管中液面始终存在高度差,说明装置气密性良好。
②如图2所示,取一定量的白磷放入燃烧匙,塞紧橡胶塞,调整管A与管B内液面处于同一水平线,读取管B内液面读数V0。
③用激光笔加热白磷并点燃白磷,若白磷燃烧的产物与红磷相同,且燃烧的生成物对会污染空气,请写出白磷燃烧的符号表达式为,待冷却至室温,调整管A与管B内液面处于同一水平线,读取管B内液面读数V1(如图3所示)。
④如图4所示,打开管A上端橡胶塞,将管A位置下移,管B上移,至管A中充满水,立即再塞紧上端橡胶塞,调整管A与管B内液面处于同一水平线,读取管B内液面读数V2。
①实验前需要在管A中预先放一部分水,其作用是。
②从环保角度分析,与教材中红磷燃烧测定空气中氧气体积含量实验比较,本实验的优点是。
某次实验记录数据如下表,请根据数据计算并填写表中空格。
|
V0/mL |
V1/mL |
V2/mL |
空气中氧气体积含量(计算结果精确到0.1%) |
|
2.28 |
9.16 |
39.28 |
|

物质 | H2 | N2 | NH3 |
沸点/℃(1.01×105Pa) | -252 | -195.8 | -33.35 |
在1.01×105Pa时,要将工业合成氨的产物氨气(NH3)从它的反应物氮气和氢气的混合物中分离开来,最适宜的温度应该控制在℃≤T<℃。

A漏斗内的滤纸有破损
B.漏斗下端未靠在烧杯内壁
C.漏斗内液面高于滤纸的边缘

《2050年世界与中国能源展望》中提出,全球能源结构正在向多元、清洁、低碳转型。太阳能的利用是热门研究方向之一。例如,可以利用太阳能将水转化为,某种光分解水的过程如图一所示,产生的H2在一定条件下与CO2反应合成液态燃料CH3OH(甲醇)。也可以在太阳光照下,通过光催化将H2O、CO2直接转化为CH3OH、H2、CO、CH4等太阳能燃料(图二)。另外,还可以利用照明灯、人体散发的热量等生活中随处可见的成热发电,我国研发的“柔性、可裁剪碲化铋(Bi2Te3)纤维素复合热电薄膜电池”,能充分贴合人体体表,实现利用体表散热为蓝牙耳机、手表、智能手环等可穿戴电子设备供电(图三)。可以看出,在新能源的开发和利用中,化学起着不可替代的作用。

【提出问题】
①二氧化锰常用作氯酸钾和过氧化氢分解的催化剂,其它物质是否也可以用作该反应的催化剂呢?
②除了催化剂还有其它因素影响化学反应的速率吗?
研究表明,许多物质对氯酸钾的分解有催化作用,分别用它们作催化剂,氯酸钾开始发生应和反应剧烈时的温度如下表所示:
氧化铁 | 氧化铝 | 氧化铜 | 氧化镁 | |
开始反应 | 420℃ | 515℃ | 305℃ | 490℃ |
剧烈反应 | 490℃ | 540℃ | 350℃ | 545℃ |
通过分析资料中的数据,实验室用氯酸钾制氧气,如果不用二氧化锰,最好选用上述表格中的某一种物质作为催化剂,写出用该方法制取氧气的符号表达式。
①将3g氯酸钾放在试管中加热。
②将3g氯酸钾与1g二氧化锰混合均匀后加热。
③将xg氯酸钾与1g氧化铜混合均匀后加热。
④从实验③反应后的固体中提取其中的氧化铜,称量,结果为1g。
⑤将实验④后得到1g固体和xg氯酸钾混合均匀后加热,现象与实验③相同。
【分析实验】
a.实验③中x的值应为。
b.通过实验④可以得出的结论是。
c.通过实验⑤可以得出的结论是。
d.实验②③对比的目的是。
【实验结论】氧化铜确实也能做氯酸钾分解的催化剂。
影响化学反应的速率除了催化剂以外,还有其它因素吗?以下是另一实验小组探究影响过氧化氢反应速率部分因素的相关实验数据。
实验序号 | H2O2溶液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
a.通过实验①和②对比可知,化学反应速率还与有关:
b.通过对比实验③和④,得出结论。