 加热液体
B .
加热液体
B .  测试溶液pH
C .
测试溶液pH
C .  气密性检查
D .
气密性检查
D .  稀释浓硫酸
稀释浓硫酸
|
|
|
|
|
| (pH:2-3) | (pH:3-4) | (pH:5-6) | (pH:7-8) |
选项 | 性质 | 用途 |
A | 氢氧化钙呈碱性 | 改良酸性土壤 |
B | 浓硫酸具有脱水性 | 干燥氧气 |
C | 稀盐酸能与某些金属氧化物反应 | 除铁锈 |
D | 氢氧化钠能与某些非金属氧化物反应 | 吸收二氧化硫 |



| 选项 | 物质 | 杂质 | 去除杂质的方法 |
| A | NaCl | Na2CO3 | 加入适量的Ca(OH)2溶液、过滤 |
| B | CaO | CaCO3 | 加水、过滤 |
| C | Fe粉 | Zn粉 | 加过量FeSO4溶液、过滤 |
| D | HCl | H2SO4 | 加Ba(NO3)2溶液、过滤 |
 B .
B .  C .
C .  D .
D . 


组别 | 盐酸的溶质质量分数(%) | 温度(℃) |
1 | 8 | 32 |
2 | 12 | 50 |
3 | 8 | 20 |
4 | 12 | 32 |

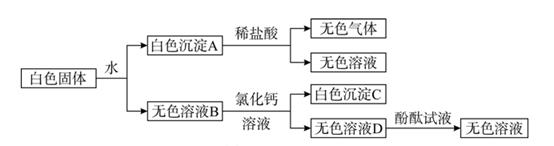
【建立猜想】①氢氧化钡过量②盐酸过量③恰好完全反应。
【实验设计】
步骤一:取少量反应后的溶液于试管中,滴入几滴无色酚酞试液,溶液不变色,得出猜想①错误。
步骤二:继续探究
|
实验方案 |
实验操作 |
实验现象 |
实验结论 |
|
Ⅰ |
重新取样,滴加少量AgNO3溶液 |
白色沉淀 |
猜想②正确 |
|
Ⅱ |
重新取样,滴加足量Na2CO3溶液 |
|
猜想②正确 |
|
白色沉淀 |
猜想③正确 |
【查阅资料】现今的粉笔品种多样,成分不一,有的主要含碳酸钙,有的主要含硫酸钙,有的还含有少量氧化钙。
【提出猜想】粉笔中可能含有碳酸钙、硫酸钙和少量氧化钙。
【验证猜想】
|
探究步骤 |
实验操作 |
获取证据方式 |
实验现象 |
|
① |
将半截白粉笔碾成粉末状,放入装有水的烧杯中 |
用手触摸烧杯 |
未感到明显的温度变化 |
|
用眼睛观察 |
有大量白色不溶物 |
||
|
② |
将半截白粉笔放入装有稀盐酸的烧杯中 |
用眼睛观察 |
粉笔断面小孔处产生用 小气泡,一会儿消失 |
|
将半截白粉笔碾成粉末状,放入装有稀盐酸的烧杯中 |
用眼睛观察 |
无气泡出现 |
|
|
③ |
取步骤①烧杯中的上层清液,滴加硝酸钡,再加稀硝酸 |
用眼睛观察 |
出现白色沉淀,且沉淀 不溶解 |
【反思和评价】

实验设计:三颈烧瓶中充满二氧化碳气体,A颈、B颈分别连接充满氢氧化钠溶液和盐酸的注射器,C颈插有两端开口的玻璃导管(伸入瓶内的一端连有小气球),装置气密性良好。
实验操作:先通过A颈往瓶内注入氢氧化钠溶液,观察到小气球的形状发生了变化;过一段时间后再通过B颈往瓶中注入盐酸,发现小气球的形状又发生了改变。请描述小气球形状的变化情况,并对此作出合理的解释。

|
实验次数 |
1 |
2 |
3 |
4 |
|
稀硫酸的用量 |
10g |
10g |
10g |
10g |
|
剩余固体的质量 |
8.7g |
a |
6.7g |
6.7g |

|
实验序号 |
1 |
2 |
3 |
|
碳酸氢钠片样品质量/克 |
3.0 |
3.0 |
3.0 |
|
反应前总质量/克 |
193.8 |
194.6 |
193.6 |
|
反应后总质量/克 |
192.6 |
193.6 |
192.5 |
|
二氧化碳质量/克 |
请计算药片中碳酸氢钠的质量分数。