选项 | 生活用途 | 化学原理 |
A | 维生素C帮助人体将 | 维生素C具有还原性 |
B | 葡萄酒中添加二氧化硫 | 二氧化硫具有漂白性 |
C | 过氧化钠用作呼吸面具中的供氧剂 | 过氧化钠分解放出氧气 |
D | 明矾可用作净水剂和消毒剂 | 铝离子水解生成氢氧化铝胶体 |
 是中问产物
D . 加入
是中问产物
D . 加入
|
|
|
|
|
|
开始沉淀pH |
1.9 |
4.2 |
6.2 |
|
沉淀完全pH |
3.2 |
6.7 |
8.2 |
下列说法错误的是( )
Mn(VII)Mn(VI)
Mn(IV)
Mn(III)
[Mn(C2O4)n]3-2n→Mn2++CO2
下列说法错误的是( )
![]()
![]()
![]()
![]()
![]()
![]()
检验溶液中BaS是否完全反应的方法是:取少量反应液,加入(填试剂),有黑色沉淀生成,则BaS未反应完全。
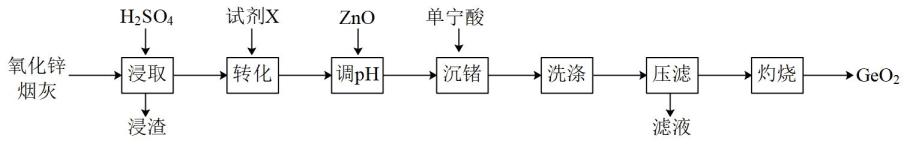
已知:①浸取后溶液pH为2,Ge以GeO2+的形式存在;
②单宁酸为复杂有机酸,易与Fe3+络合沉淀。

一段沉锗单宁酸总用量/倍 | 10 | 15 | 20 | 25 | 30 |
锗沉淀率/% | 88.5 | 89.5 | 90.5 | 91.5 | 93.5 |
二段沉锗单宁酸总用量/倍 | 10 | 15 | 20 | 25 | 30 |
锗沉淀率/% | 92 | 93.5 | 94.5 | 97 | 97.5 |
实验序号 | ⅰ | ⅱ |
所加试剂 |
|
|
| ≈50% | ≈100% |
分析ⅱ中的去除率提高的原因:
a.直接还原
了。
通过计算说明电子得、失数量关系:,证明该原因不合理。
b.研究发现:(导电)覆盖在铁粉表面;随着反应的进行,产生
(不导电),它覆盖在
表面,形成钝化层,阻碍电子传输。
c.能与
反应生成
。
用做同位素示踪实验,证明该原因合理。
d.破坏钝化层。
将ⅱ中的替换为,
的去除率约为50%,证明该原因不合理。
步骤1.取v含氮(
)水样,加入催化剂、
标准溶液(过量),再加入稀
。
步骤2.用标准溶液滴定剩余的
(
被还原为
),终点时消耗
。
已知:
①水样中的含量为
。
②溶液中影响测定。向步骤1中加入适量
, 产生
驱赶
, 否则会使测定结果(填“偏大”或“偏小”)。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、
(紫色)。
ii.浓碱条件下,可被OH-还原为
。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

序号 | 物质a | C中实验现象 | |
通入Cl2前 | 通入Cl2后 | ||
I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
II | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
III | 40%NaOH 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将氧化为
。
①化学方程式表示可能导致溶液碱性减弱的原因,但通过实验测定溶液的碱性变化很小。
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为,溶液绿色缓慢加深,原因是MnO2被(填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因。