元素符号:Sb 原子序数:51 相对原子质量:121.8 价电子排布式:5s25p3 |

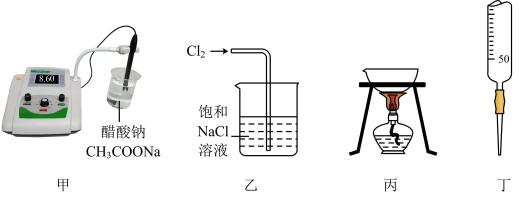
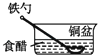 B .
B .  C .
C . 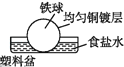 D .
D . 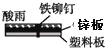
选项 | 实验操作 | 现象 | 结论 |
A | 常温下将Ba(OH)2•8H2O晶体与NH4Cl晶体在小烧杯中混合 | 烧杯壁变凉 | 该反应是吸热反应 |
B | 将充有NO2的密闭烧瓶放入热水中 | 烧瓶内气体颜色变深 | NO2生成N2O4的反应中,△H>0 |
C | 将0.1mol/L的弱酸HA稀释成0.01mol/L,测量稀释前后溶液pH | pH增大 | 稀释后HA电离程度减小 |
D | 常温下向物质的量浓度均为0.1mol/L的NaCl和NaI混合溶液中逐滴滴入AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |



a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性

Cu2(OH)3Cl属于(填“无害锈”和“有害锈”),请解释原因。

①过程I的正极反应物是。
②过程I负极的电极反应式是。
i.柠檬酸浸法:将腐蚀文物直接放在2%—3%的柠檬酸溶液中浸泡除锈;
ii.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)3Cl;
iii.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl- , 能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”

①用离子方程式表示溶液中的转化反应。
②由图可知,溶液酸性增大,CrO的平衡转化率填(“增大”“减小”或“不变”)根据A点数据,计算出该转化反应的平衡常数为。
③升高温度,溶液中的平衡转化率减小,则该反应的0(填“大于”“小于”或“等于”)。