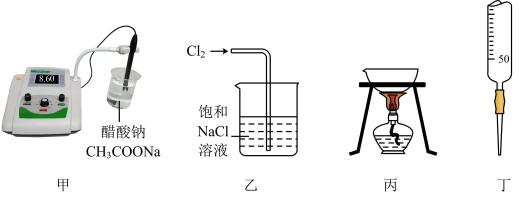


 D . 一定条件下,m能与Z的单质反应生成p
D . 一定条件下,m能与Z的单质反应生成p
| 弱酸 | HF | CH3COOH | H2CO3 | H2S |
| 电离平衡常数 | Ka=7.2×10-4 | Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-12 |

①a点所示的溶液中c(NH3·H2O)c(Cl-)。
②b点所示的溶液中c(Cl-)c()。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为。
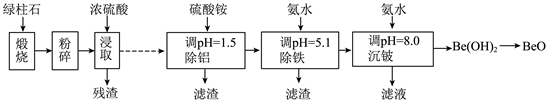
回答问题:
元素Al与Si中,第一电离能较大的是,氮原子和氧原子电负性较大的是。
请回答:
Cu(s)+2H2SO4(l)=CuSO4(s)+SO2(g)+2H2O(l)ΔH=-11.9kJ·mol-1。
判断该反应的自发性并说明理由。
①反应开始到第10分钟,SO3反应速率为。
②该温度下反应的平衡常数为。
③平衡时SO2的转化率为。
①下列说法正确的是。
a.须采用高温高压的反应条件使SO2氧化为SO3
b.通入过量的空气可以提高含硫矿石和SO2的转化率
c.进入接触室之前的气流无需净化处理
②在焙烧前要将硫铁矿粉碎,这样做的目的是。
2FeSO4(s)Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ)。平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)kPa。Kp(I)随反应温度升高而(填“增大”“减小”或“不变”)。


完成下列填空:

写出该反应的化学方程式。