 B . 电子式
B . 电子式 C . 球棍模型
C . 球棍模型 D . 空间充填模型
D . 空间充填模型


选项 | A | B | C | D |
实验目的 | 吸水性 | 脱水性 | 稀释放热 | 强氧化性 |
实验装置 |
|
|
|
|


已知: SiHCl3 遇水H2O 强烈水解,在空气中易自燃。下列说法错误的是( )


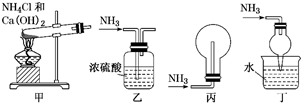
I.某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。


在一定温度下按图示装置进行实验。打开K1 , 推动注射器活塞,使X中的气体缓慢通入Y管中,反应的化学方程式。

回答下列问题:
仪器a的名称是,装置I中反应的化学方程式为。
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大。
可行的是____(填编号)。
实验编号 | 温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
I | 25 | 0.1 | 0.1 |
II | 25 | 0.2 | 0.1 |
III | 50 | 0.2 | 0.1 |
①上述实验中溶液最先变浑浊的是。(填实验编号,下同)
②为探究浓度对化学反应速率的影响,应选择实验和。
化学键 | H—H | O=O | H—O |
键能(kJ·mol-1) | 436 | 496 | 463 |
则生成1molH2O(g)可以放出kJ热量。
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
f.葡萄糖在人体内氧化分解
装置 |
|
|
|
现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置甲溶液中的阴离子移向(填“A”或“B”)极。
②装置乙中正极的电极反应式为。
③四种金属活动性由强到弱的顺序是。
