
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定为 |
D | 将少量有机物滴加到新制氢氧化铜溶液中,充分振荡,未见红色沉淀生成 | 该有机物不含醛基 |
选项 | 客观事实 | 类推结论 |
A | 将铜片加入足量稀硝酸中,铜片会被溶解 | 将铜片加入足量稀盐酸中,铜片也会被溶解 |
B | H2S和CuSO4溶液反应有黑色沉淀生成 | H2S和CuCl2溶液反应也有黑色沉淀生成 |
C | 向AgNO3溶液中滴加过量NaOH溶液,最终有沉淀生成 | 向AgNO3溶液中滴加过量的氨水,最终也有沉淀生成 |
D | 将CO2通入Ba(NO3)2溶液中无明显现象 | 将SO2通入Ba(NO3)2溶液中也无明显现象 |


编号 | 0 | 20 | 40 | 60 | 80 | |
① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
② | a | 1.20 | 0.80 | 0.40 | x | |
③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
已知:①NaNO2具有毒性和强氧化性;②酸性强弱:H2SO3>HNO2>CH3COOH。
a.二氧化碳 b.二氧化硫 c.醋酸 d.稀硫酸
上述反应体系中属于非极性分子的化合物是。
恒温恒容时,该反应一定处于平衡状态的标志是。
a.υ正(H2S)=2υ逆(H2) b.CH4的体积分数不再变化
c.不再变化 d.混合气体的密度不再改变
a.一定改变 b.可能增大 c.可能减小 d.可能不变
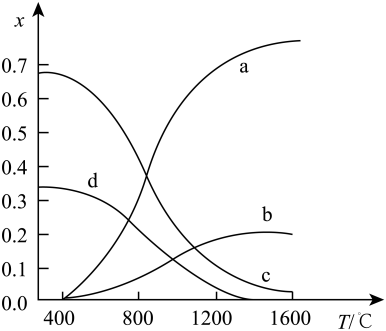
图中表示H2物质的量分数变化的曲线是(选填字母),该反应的正反应为反应(选填“放热”或“吸热”)。保持其他条件不变,升高温度测得CH4的平衡转化率先增大后下降,其原因可能是。
已知:S+Na2SO3Na2S2O3
按如图所示装置(加热及夹持装置省略)进行实验,再经多步操作制得Na2S2O3﹒5H2O的粗产品![]()
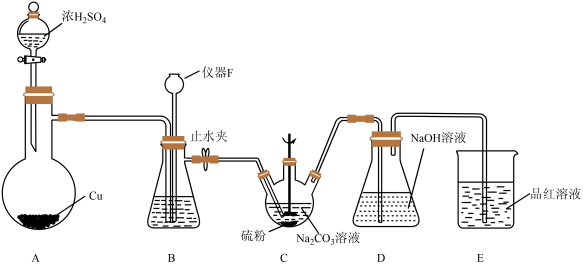
仪器F的名称为,装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
称取粗产品12.400g配制成100mL溶液,取25.00mL该溶液于锥形瓶中,用0.2500mol·L-1的I2标准液滴定,反应原理为:I2+2S2O→2I-+S4O
, 实验数据如表:
编号 | 初读数(mL) | 末读数(mL) |
① | 0.00 | 19.99 |
② | 1.00 | 21.01 |
③ | 1.00 | 23.00 |
用作为指示剂,滴定至终点时溶液的颜色由色变为色,且30s内溶液颜色不变。粗产品中Na2S2O3﹒5H2O的质量分数为。下列情况可能导致测量结果偏低的操作是 。
a.粗产品中Na2S2O3﹒5H2O失去部分结晶水
b.滴定前装I2标准液的滴定管未用标准液润洗
c.锥形瓶用蒸馏水洗净后未用待测液润洗
d.滴定时锥形瓶中有少量液滴溅出
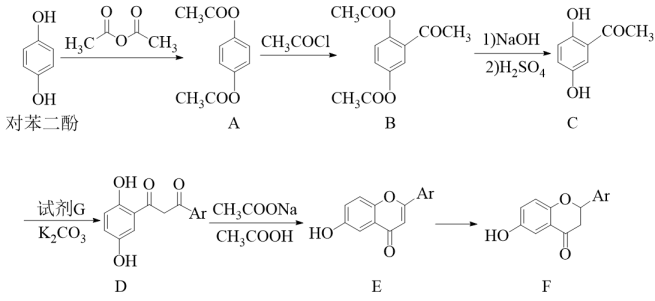
已知:RCOCH3+R′COClRCOCH2COR′+HCl
①苯环上有2个取代基
②可发生水解反应和银镜反应
③可与金属钠Na反应生成H2 , 且苯环上的一氯代物只有2种
 为原料,参照题中所给信息(其它试剂任选)设计合成
为原料,参照题中所给信息(其它试剂任选)设计合成 的路线(不超过三步,无机试剂任选)。
的路线(不超过三步,无机试剂任选)。(合成路线可表示为:AB……
目标产物)