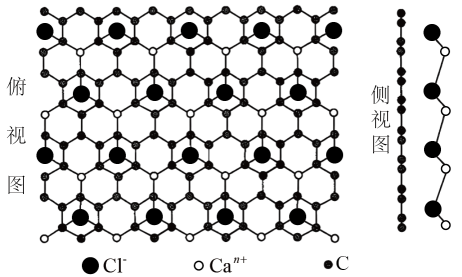
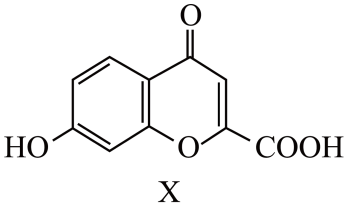
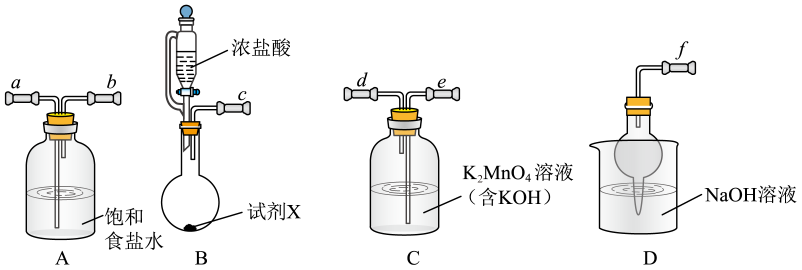
已知:K2MnO4在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
3MnO+2H2O=2MnO
+MnO2↓+4OH-。
下列说法错误的是

已知:①1-丁醇微溶于水,易溶于乙醚;
②R-CHO+NaHSO3(饱和)→R-CH(OH)SO3Na↓。
下列说法错误的是
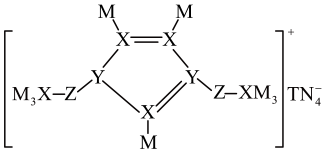
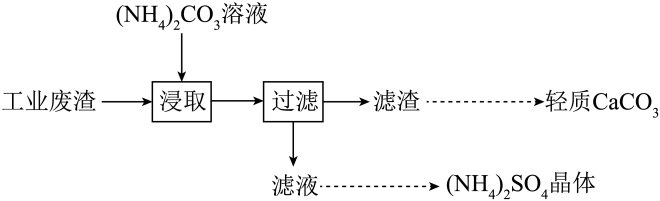
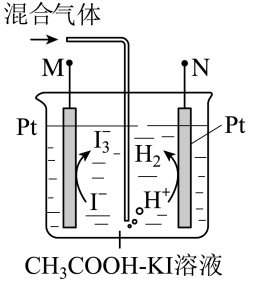
| 选项 | 实验操作和现象 | 结论 |
| A | 向2mL1mol•L-1硼酸溶液中加入1mL1mol•L-1碳酸钠溶液,溶液无明显变化 | 硼酸与碳酸钠不反应 |
| B | 将铜丝灼烧至表面变黑,伸入盛有某有机物的试管中,铜丝恢复亮红色 | 该有机物中含有醇羟基 |
| C | 充分加热铁粉和硫粉的混合物,冷却后取少量固体于试管中,加入足量稀硫酸,再滴入K3[Fe(CN)6]溶液,产生蓝色沉淀 | 铁被硫氧化至Fe(II) |
| D | 向新制硫酸亚铁溶液中滴加邻二氮菲( | 与邻二氮菲配位能力:H+>Fe2+ |

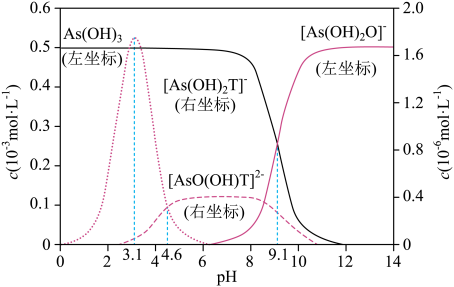
已知:Ka1(H2T)=10-3.04 , Ka2(H2T)=10-4.37。
下列说法正确的是

①在(CH3)3SiCl、(CH3)3SiF、(CH3)4Si中,C-Si-C键角最大的是,原因是。
②C5H表示环戊二烯负离子,已知分子中的大π键可用符号π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
),则C5H
中的大π键应表示为。
③该铁的配合物中碳原子的杂化方式共有种。

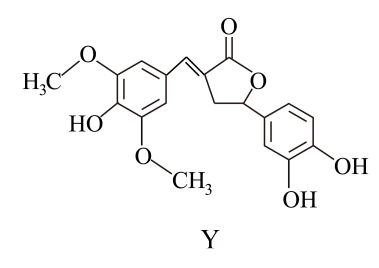
①普鲁士蓝中Fe2+与Fe3+个数之比为;该晶胞的化学式为。
②若所有铁粒子为等径小球,则K+与Fe2+之间最近距离为pm;该晶体的密度为g•cm-3(阿伏加德罗常数为NA)。
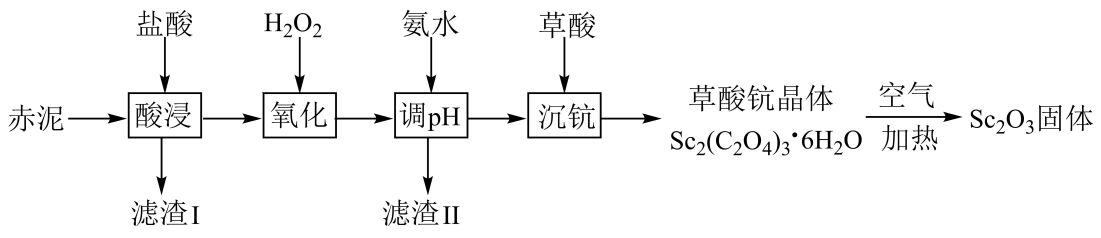
已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
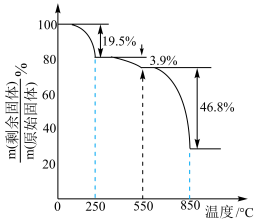
250℃时固体的主要成分是(填化学式);550~850℃时反应的化学方程式为。
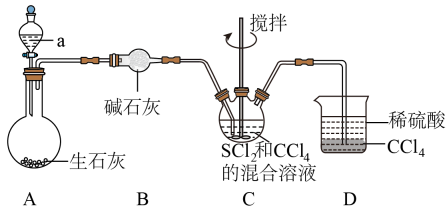
已知:S4N4+6OH-+3H2OS2O
+2SO
+4NH3↑
回答下列问题:
i.蒸氨:取0.1000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热蒸出的NH3通入含有V1mLc1mol•L-1H2SO4标准溶液的锥形瓶中。
ii.滴定:用c2mol•L-1溶液滴定剩余的H2SO4 , 消耗V2mLNaOH溶液。
①滴定管的正确操作顺序:检漏→蒸馏水洗涤→(填标号)→开始滴定。
a.装入滴定液至“0”刻度以上
b.调整滴定液液面至“0”刻度
c.排除气泡
d.用滴定液润洗2至3次
e.记录起始读数
②滴定时选用的指示剂为;在接近终点时,放液使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,,继续摇动锥形瓶,观察溶液颜色变化。
③S4N4的纯度表达式为;若所用NaOH溶液实际浓度偏低,测定结果(填“偏高”“偏低”或“无影响”)。
①能发生银镜反应和水解反应,水解产物遇FeCl3溶液显色;
②苯环上有三个取代基,且苯环上的一氯代物只有两种;
③核磁共振氢谱有5组峰,且峰面积之比为12:2:2:1:1。
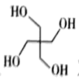 )是一种重要的化工原料,设计由甲醛和乙醇为起始原料制备季戊四醇的合成路线(无机试剂任选)。
)是一种重要的化工原料,设计由甲醛和乙醇为起始原料制备季戊四醇的合成路线(无机试剂任选)。
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49kJ•mol-1
II.CO2(g)+H2(g) CO(g)+H2O(g) △H2
回答下列问题:
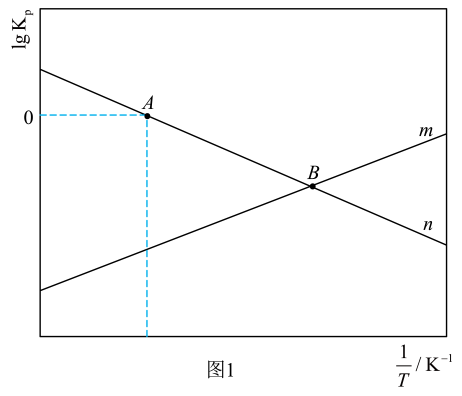
①反应Ⅱ对应图1中(填“m”或“n”);A点对应温度下体系达到平衡时CO2的转化率为80%,反应Ⅰ的Kp=kPa-2(保留两位有效数字)。
②通过调整温度可调控平衡时的值。B点对应温度下,平衡时
=400,则p(H2)= kPa。
