|
A |
B |
C |
D |
|
|
实验装置 |
检查气密性 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
探究燃烧的条件 |
|
解释 |
烧杯中的水:方便观察有无气泡冒出 |
量筒中的水:吸收反应放出的热量 |
集气瓶底部少量的水:冷却溅落的融熔物,防止集气瓶炸裂 |
烧杯中的水:加热铜片,隔绝空气 |
 B .
B .  C .
C . 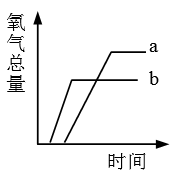 D .
D . 


步骤1:检查装置的气密性;
步骤2:在塑料瓶中加入两片形状、大小相同的平菇,在
塑料瓶中加入
质量分数为5%的过氧化氢溶液,然后依次打开弹簧夹
和
, 过氧化氢溶液进入
塑料瓶与平菇接触,立即产生大量气体;
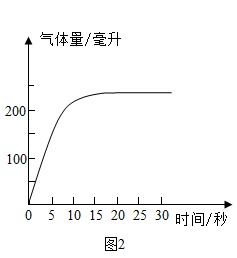
步骤3:使用气体收集装置进行氧气收集,每隔记录一次,根据数据绘制如图曲线。


⑴检查装置气密性。
⑵称取1克苹果,切成小块放入烧瓶中,量取10毫升溶质质量分数为5%的过氧化氢溶液倒入烧瓶中,迅速塞紧塞子,当液滴移至A点时开始计时。
⑶当观察到液滴恰好至B点时(AB间玻璃管容积为6毫升),记录所需时间。
⑷依次用不同质量的苹果重复步骤2和3,记录并处理数据,结果如图乙。
①小明把烧瓶放在盛有水的水槽中进行实验,目的是为了保持温度不变。温度升高会导致液滴移动变快,原因是(例举一个)
②第(3)步除了可以用记录液滴移动相同距离所用时间来比较分解速度外,还可以用什么方法来比较。
③本实验可得出的结论是。
④若用20毫升5%的过氧化氢溶液与6克苹果重复上述实验,预测实验中步骤3记录的时间是秒。

请根据你对上述实验的理解,回答下列问题。

①用高锰酸钾制取一瓶氧气;
②粗略测定加热一定质量的高锰酸钾所收集到的氧气体积。
反应原理:加热高锰酸钾制取氧气,其化学反应方程式为_。
a→→d。

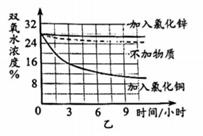
| 组别 | 温度(℃) | 双氧水分解生成氧气的体积(升) | |||||
| 5% | 10% | 15% | 20% | 25% | 30% | ||
| 1 | 20 | 0 | 2 | 4 | 7 | 13 | 21 |
| 2 | 30 | 1 | 5 | 18 | 39 | 75 | 110 |

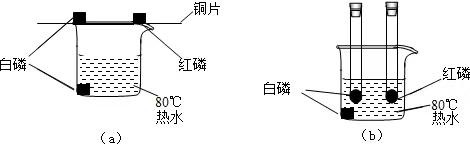

观察到:Ⅰ、Ⅱ中铁丝都剧烈燃烧,Ⅱ中铁丝燃烧比Ⅰ中的更剧烈;Ⅲ中铁丝没有燃烧。请分析Ⅲ中铁丝不能燃烧的原因是。
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,
也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由(填“固态”或“气态”)物质燃烧形成的。

【查阅资料】
|
物质/℃ |
熔点/℃ |
沸点/℃ |
燃烧时温度/℃ |
|
石蜡 |
50-70 |
300-350 |
约600 |
|
铁 |
1535 |
2750 |
约1800 |
|
钠 |
97.8 |
880 |
约1400 |
由上表可知:物质燃烧能否产生火焰与其(填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时,(填“有”或“没有”)火焰产生。
[实验1]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃时停止收集,测定瓶中氧气的含量,重复实验3次。
[实验2]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃后,继续收集40秒,测定瓶中氧气的含量,重复实验3次。
[实验3]用排水法收集氧气,测定瓶中氧气的含量,重复实验3次。
|
实验1 |
实验2 |
实验3 |
|||||||
|
氧气的体积分数(%) |
79.7 |
79.6 |
79.9 |
88.4 |
89.0 |
87.9 |
90.0 |
89.8 |
89.3 |
|
氧气的平均体积分数(%) |
79.7 |
88.4 |
89.7 |
||||||


|
1号瓶(收集34%的氧气) |
2号瓶(收集35%的氧气) |
3号瓶(收集36%的氧气) |
4号瓶(收集37%的氧气) |
|
不复燃 |
不复燃,但很亮 |
很亮,复燃 |
立即复燃 |
某同学根据实验现象得出结论:“氧气约占36%时就是带火星木条复燃的最低体积分数”,而其他同学立即反对,原因是。