 土壤加水搅拌
B .
土壤加水搅拌
B .  过滤
C .
过滤
C . 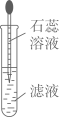 检验酸碱性
D .
检验酸碱性
D . 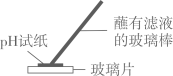 测定pH
测定pH




选项 | 实验目的 | 实验操作 |
A | 除去粗盐中的泥沙 | 溶解、蒸发结晶 |
B | 除去炭粉中的铁粉 | 滴加足量稀盐酸,过滤,洗涤,干燥 |
C | 除去CO2中混有HCl | 将气体通入氢氧化钠液中 |
D | 比较锌、铁、铜的金属活动性 | 将铜片和铁片分别插入硫酸锌溶液中 |

a CH4 b CO c SO2
a 用熟石灰处理废水中的酸 b 用活性炭处理废水中的色素和异味 c 用铁粉回收废水中的铜
a 废气直接排放 b 废干电池就地填埋 c 废旧塑料随意丢弃
a 漂白粉 b 明矾 c 臭氧

①上述物质中属于有机物的是(填序号)。
②反应前后未发生改变的微粒有(填微粒符号)。

①初始时氧气的体积分数不为0,原因是。
②使H2O2分解较快的催化剂是(填MnO2或FeCl3)。判断依据是。
③用5% H2O2溶液制取氧气,若采用下图所示装置进行实验,上述两种催化剂中较为合适的是。


①向其中一套锥形瓶内加入30mL水,搅拌一段时间后打开止水夹,观察到轻质塑料球向左移动一小段,移动原因是。
②向另一套装置的锥形瓶内加入30mL6%的NaOH溶液,搅拌一段时间后打开止水夹,观察到轻质塑料球向左移动的距离比①中大得多,主要原因可用化学方程式表示为,随后,向锥形瓶内加入足量稀盐酸搅拌,可观察到轻质塑料球(选填向左”、“向右”或“不”)移动。

①浸取时,水温易升高的原因是。
②浸取后,混合物经(填操作名称)弃去废渣,得到浸出液。
钠元素在自然界中分布很广,储量极为丰富,常以氯化钠、碳酸钠、硫酸钠等物质存在。
19世纪初,英国化学家戴维在实验室中首次制得了金属钠。
钠是一种银白色金属,质软,密度为0.97g/cm3 , 熔点为97.8℃,金属钠的性质很活泼,能与许多物质发生化学反应。钠暴露在空气中,与氧气反应生成氧化钠(Na2O),钠在空气中燃烧,生成淡黄色的过氧化钠(Na2O2);钠遇水立即发生剧烈反应,生成氢氧化钠和氢气。因此,实验室常将钠保存在煤油中。
金属钠的用途广泛。钠和钾形成的合金熔点低,常温下呈液态,可用作快中子反应堆的热交换剂。利用钠的强还原性,在一定条件下可以将钛(Ti)、锆(Zr)等稀有金属从其氯化物中置换出来。
工业上通常采用电解熔融氯化钠的方法制取单质钠。
a 导电性 b 导热性 c 延展性
人体缺钙可能会导致____。
提出问题:钙的化合物很多,为什么我们很少提起单质钙呢?
思考猜想:钙的化学性质活泼。
实验验证一:

查阅资料:在一个化学反应中,有元素化合价升高,同时就有元素化合价降低。
实验结论:
①写出钙与水反应的化学方程式:。
②该反应属于反应。(选填“吸热”或“放热”)
提出问题:一包生石灰干燥剂,使用一段时间后可能有哪些固体?
猜想假设:固体中含有氧化钙、氢氧化钙、碳酸钙。
固体中除了氧化钙、氢氧化钙外,还可能会含有碳酸钙的依据是(用化学方程式表示)。
取固体样品加入水中,滴加酚酞后液体变红;继续加足量稀盐酸,如观察到有气泡产生,则该固体中一定含有。

查阅资料:Ca(OH)2加热至580℃、CaCO3加热至825℃分别分解生成两种氧化物。
碱石灰的主要成分为氧化钙和氢氧化钠。
①实验前首先要连接仪器,检查装置的气密性,再装入样品。
②在B装置中放入155g固体样品,控温加热使装置B中反应完全,再通一段时间空气,测得反应前后装置C、D分别增重18.0g和22.0g,则固体样品中含有的物质为。
③装置E的作用是。