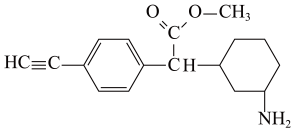
 测定中和反应反应热
B .
测定中和反应反应热
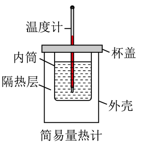
B .  除去Fe2(SO4)3溶液中的FeSO4
C .
除去Fe2(SO4)3溶液中的FeSO4
C . 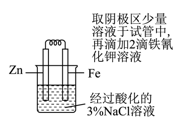 验证牺牲阳极法保护铁
D .
验证牺牲阳极法保护铁
D . 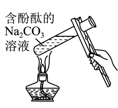 验证温度对水解平衡的影响
验证温度对水解平衡的影响
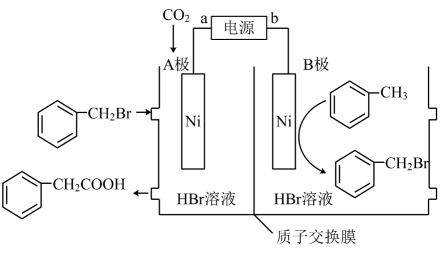
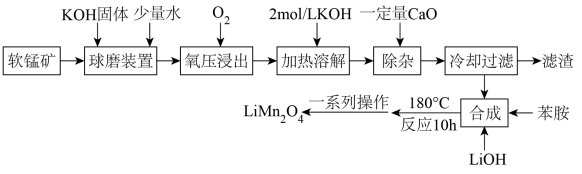
已知:
①软锰矿的成分如下:
|
成分 |
MnO2 |
Fe2O3 |
CaO |
SiO2 |
其他不反应杂质 |
|
质量分数 |
69.6% |
7.6% |
5.6% |
9.0% |
8.2% |
②K2MnO4在强碱性溶液(pH大于13.5)中稳定,在酸性、中性和弱碱性环境中会发生歧化反应生成和MnO2。
③苯胺(C6H5NH2)还原性较强,在该条件下可被氧化为硝基苯(C6H5NO2)。
④锰酸锂为灰黑色粉末,离子化合物,易溶于水,难溶于无水乙醇。
①若反应时,N元素的化合价不变,则锰酸锂与稀硝酸和双氧水反应的离子方程式为。
②样品中锰酸锂的纯度为%(保留两位有效数字)。
步骤一:向三颈烧瓶中加入少量磁力搅拌子,再加入10.00mL(密度为1.26g/mL)CS2。
步骤二:用恒压滴液漏斗向三颈烧瓶中加入50mLl.00mol/L的Na2S溶液,再向球形冷凝管中通入冷水,打开磁力搅拌器和加热装置,控制温度在25℃反应15min,关掉磁力搅拌器和加热装置。待溶液冷却后, (实验操作),得M的溶液,通过处理后得M晶体(Na2CS3·xH2O)。

步骤三:再将温度分别控制在30℃、35℃、40℃、45℃,重复以上操作,可得反应温度对全硫碳酸钠产率的影响如图乙;硫化钠和二硫化碳分别在40℃和45℃反应时,反应时间对全硫碳酸钠产率的影响如图丙。

已知:CS2易燃,有毒,不溶于水,沸点为46℃,能与NaOH溶液反应。
回答下列问题:
步骤一三颈烧瓶中加入的CS2是否过量(填“是”或“否”),发生反应的化学方程式为:。
M溶液显碱性的原因是(用离子方程式表示)。
反应Ⅰ:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1
反应Ⅱ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2

实验序号 | 1 | 2 | 3 |
CH4浓度/mol·L-1 | 0.1000 | 0.2000 | 0.2000 |
H2O浓度/mol·L-1 | 0.1000 | 0.1000 | 0.2000 |
速率/mol·L-1·s-1 | 3.75×10-4 | 1.50×10-3 | 3.00×10-3 |
若某时刻,测得c(CH4)=0.4000mol·L-1 , c(H2O)=0.4000mol·L-1 , 则此时的反应速率v正=。

①600℃时,若经过tmin,反应达到平衡。该条件下,反应I的Kp=(MPa)2(列出计算式即可)。
②H2的含量在740℃左右出现峰值的原因为。

①CH4参与的电极反应为。
②经测定,原料气中各气体的体积分数为:
气体 | H2 | CH4 | CO | CO2 |
体积分数 | 82% | 3% | 5% | 10% |
若电解过程中消耗了100m3的原料气,则可得到相同条件下纯净H2m3。
![]()


①阿伏加德罗常数的值为NA , 则该晶体密度为g·cm-3.(用含a,NA的表达式表示)。
②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能,Ni-N键中离子键成分的百分数小于Ni-O键,原因是。
③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为;N所替代的O的位置可能是。
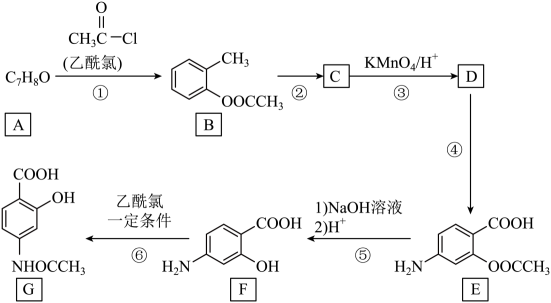
已知:
①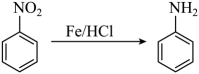 (苯胺,呈碱性,易被氧化)。
(苯胺,呈碱性,易被氧化)。
②甲基吡啶(![]() )和苯胺互为同分异构体,并具有芳香性。
)和苯胺互为同分异构体,并具有芳香性。
③苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位:苯环上有羧基时,新引入的取代基连在苯环的间位。
回答下列问题:
①分子结构中含一个六元环,且环上一氯代物只有一种
②1mol该物质与足量NaHCO3反应生成2molCO2
③核磁共振氢谱有4组峰,峰面积之比为6:4:2:1