实验1 | 在 5 mL水中滴加2滴饱和FeCl3溶液,呈棕黄色:煮沸,溶液变为红褐色。 |
实验2 | 在 H2O2溶液中滴几滴FeCl2溶液,溶液变黄, 一段时间后溶液中有大量气泡。 |
实验3 | 在5mL 0.1 mol·L-1 KI溶液中加入3 mL0.1 mol·L-1 FeCl3溶液:将上述混合液分成两份,一份加入1 mL CCl4充分振荡、静置,下层显紫色;另一份加入1滴KSCN溶液,溶液变红。 |
依据上述实验现象,结论不合理的是 ( )

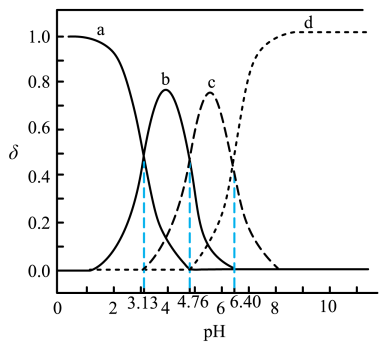
已知:本题中涉及的部分难溶电解质的溶度积如下表:
难溶电解质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 4.0×10-38 | 8.0 ×10-16 | 4.6×10-33 | 1.8×10-11 |
回答下列问题:

将新制Na2SO3溶液和CuSO4溶液按一定量混合, 加热至90℃并不断搅拌。反应生成Cu2O,同时有SO2气体产生。反应结束后,经过滤、洗涤、干燥得到Cu2O粉末。制备装置如图所示:

仪器a的名称是;反应采用的加热方式为。
称取m g样品置于烧杯中,加入足量FeCl3溶液,完全溶解后,加入4滴邻菲罗啉指示剂,然后用c mol·L-1硫酸高铈[Ce(SO4)2]溶液进行滴定至终点,共消耗Ce(SO4)2溶液VmL。(已知: Ce4++Fe2+ = Ce3++Fe3+)
加入FeCl3溶液时发生反应的离子方程式为。
Ⅱ.副反应CO2(g)+ H2(g) =CO(g)+ H2O(g) ΔH2= + 41 kJ/mol
回答下列问题:
已知:
①H2(g)+O2(g) = H2O(g) ΔH = -242 kJ/mol
②CH3OH(g) +O2(g) = CO2(g) + 2H2O(g) ΔH = -677 kJ/mol
则ΔH1 =kJ/mol, 该反应在(填“低温”或“高温”)易自发进行。

已知: CH3OH的选择性=
①用各物质的平衡分压p(B)表示反应I的平衡常数表达式Kp=;
②该反应体系中的催化剂活性受温度影响变化不大。图中表示CH3OH选择性变化的曲线是 (填 “a”或“b”),其原因是。
③当T= 250℃时,H2的平衡转化率α(H2)=。
(i) 2CO2+2e →
(ii)→
+ CO2
(iii) +
→2
+C
电池的正极反应式为。
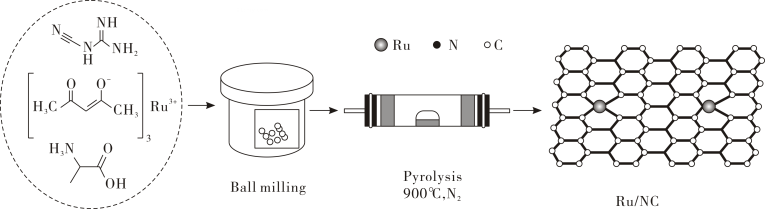
①按电子排布,氮元素位于元素周期表区, 基态氮原子的电子占据的最高能级电子云轮廓图为形。
②由图可知Ru/NC中存在(填标号)。
A.金属键 B.配位键 C. σ键 D. π键
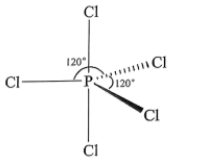
③  中C的杂化类型为。
中C的杂化类型为。
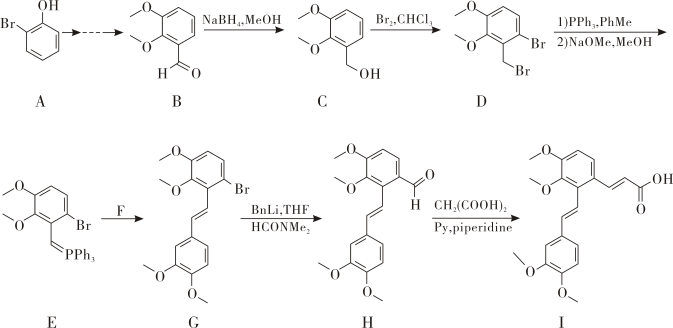
已知:  (Ph表示苯基)
(Ph表示苯基)
请回答:
A的名称是。
(i)能发生银镜反应;
(ii) 能发生水解反应;
(iii) 核磁共振氢谱表明有4组峰且峰面积之比为6:2:1:1.
 (反应条件可不写)。
(反应条件可不写)。