 , 则产物为
, 则产物为
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验某无色溶液中是否含有NO | 取少量该溶液于试管中,加稀盐酸酸化,再加入FeCl2溶液 | 若溶液变黄色且试管上部产生红棕色气体,则该溶液中含有NO |
| B | 探究KI与FeCl3反应的限度 | 取5 mL 0.1 mol·L-1KI溶液于试管中,加入1 mL 0.1 mol·L-1 FeCl3溶液,充分反应后滴入5滴15% KSCN溶液 | 若溶液变血红色,则KI与FeCl3的反应有一定限度 |
| C | 判断某卤代烃中的卤素 | 取2 mL卤代烃样品于试管中,加入5 mL 20% KOH水溶液混合后加热,再滴加AgNO3溶液 | 若产生的沉淀为白色,则该卤代烃中含有氯元素 |
| D | 探究蔗糖在酸性水溶液中的稳定性 | 取2mL20%的蔗糖溶液于试管中,加入适量稀 H2SO4后水浴加热5 min;再加入适量新制Cu(OH)2悬浊液并加热 | 若没有生成砖红色沉淀 ,则蔗糖在酸性水溶液中稳定 |
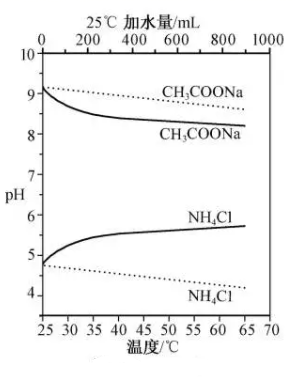
| t/min | 0 | 20 | 40 | 60 | 80 |
| c/(mol·L-1) | 0.80 | 0.40 | 0.20 | 0.10 | 0.050 |
下列说法错误的是( )
氧化物( | 产品中 | 产品中Mg杂质含量/% (以 | |||
计算值 | 实测值 | ||||
2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
备注:ⅰ、浸出率=(浸出的
质量/煅烧得到的
质量)
(M代表Ca或Mg)
ⅱ、纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度。
①解释“浸钙”过程中主要浸出的原因是。
②沉钙反应的离子方程式为。
③“浸钙”过程不适宜选用的比例为。
④产品中纯度的实测值高于计算值的原因是。
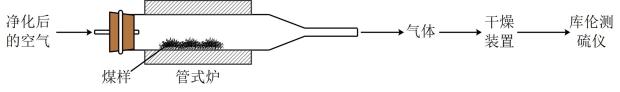
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含。
已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中保持定值时,电解池不工作。待测气体进入电解池后,
溶解并将
还原,测硫仪便立即自动进行电解到
又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。

①在电解池中发生反应的离子方程式为。
②测硫仪工作时电解池的阳极反应式为。
已知:电解中转移电子所消耗的电量为96500库仑。
①测定过程中,需控制电解质溶液 , 当
时,非电解生成的
使得测得的全硫含量偏小,生成
的离子方程式为。
②测定过程中,管式炉内壁上有残留,测得全硫量结果为。(填“偏大”或“偏小”)
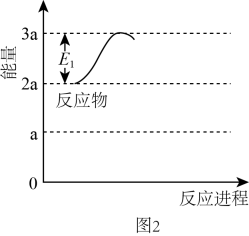
①若反应为基元反应,且反应的与活化能(Ea)的关系为
。补充完成该反应过程的能量变化示意图(图2)。
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入和
, 反应平衡后测得容器中
。则
的转化率为,反应温度t约为℃。
催化剂 | t=350℃ | t=400℃ | ||
催化剂Ⅰ | 10.8 | 12722 | 345.2 | 42780 |
催化剂Ⅱ | 9.2 | 10775 | 34 | 38932 |
在选择使用催化剂Ⅰ和350℃条件下反应,生成
的平均反应速率为
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是。
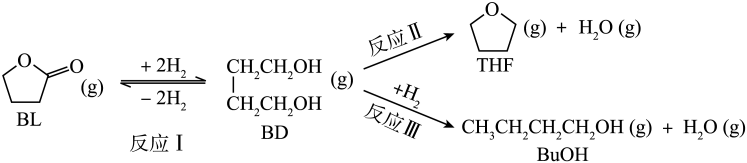
已知:①反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ、Ⅲ的影响;②因反应Ⅰ在高压氛围下进行,故
压强近似等于总压。回答下列问题:

简要步骤如下:
Ⅰ.在瓶A中加入液氨和
, 通入氨气排尽密闭体系中空气,搅拌。
Ⅱ.加入钠粒,反应,得
粒状沉积物。
Ⅲ.除去液氨,得产品。
已知:几乎不溶于液氨,易与水、氧气等反应。
请回答:
准确称取产品→→→→计算
a.准确加入过量的水
b.准确加入过量的标准溶液
c.准确加入过量的标准溶液
d.滴加甲基红指示剂(变色的范围4.4~6.2)
e.滴加石蕊指示剂(变色的范围4.5~8.3)
f.滴加酚酞指示剂(变色的范围8.2~10.0)
g.用标准溶液滴定
h.用标准溶液滴定
i.用标准溶液滴定
在某温度下达到平衡,测得密闭系统中各组分浓度分别为、
、
, 计算该温度下的平衡常数K=。
Ⅰ
Ⅱ
总反应:
Ⅲ
投料按体积之比 , 并用
稀释;常压、不同温度下反应相同时间后,测得
和
的体积分数如下表:
|
温度/ |
950 |
1000 |
1050 |
1100 |
1150 |
|
|
0.5 |
1.5 |
3.6 |
5.5 |
8.5 |
|
|
0.0 |
0.0 |
0.1 |
0.4 |
1.8 |
请回答:
①反应Ⅲ能自发进行的条件是。
②下列说法正确的是。
A.其他条件不变时,用替代
作稀释气体,对实验结果几乎无影响
B.其他条件不变时,温度越高,的转化率越高
C.由实验数据推出中的
键强于
中的
键
D.恒温恒压下,增加的体积分数,
的浓度升高
③若将反应Ⅲ看成由反应Ⅰ和反应Ⅱ两步进行,画出由反应原料经两步生成产物的反应过程能量示意图。

④在、常压下,保持通入的
体积分数不变,提高投料比
,
的转化率不变,原因是。
⑤在范围内(其他条件不变),
的体积分数随温度升高发生变化,写出该变化规律并分析原因。
Ⅰ.
Ⅱ.
①下列说法正确的是;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为
,
的物质的量为
。此时,整个体系(填“吸收”或“放出”)热量
,反应Ⅰ的平衡常数
(以分压表示,分压=总压×物质的量分数)。

①某温度下,吸收塔中 溶液吸收一定量的
后,
,则该溶液的
(该温度下
的
);
②再生塔中产生 的离子方程式为;
③利用电化学原理,将 电催化还原为
,阴极反应式为。
一些难溶电解质的溶度积常数如下表:
难溶电解质 | ||||
一定条件下,一些金属氢氧化物沉淀时的如下表:
金属氢氧化物 | ||||
开始沉淀的 | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的 | 3.2 | 8.3 | 4.6 | 9.1 |
回答下列问题:
(ⅰ)能被氧化的离子是;
(ⅱ)促进了金属
在醋酸中转化为
, 其化学方程式为;
(ⅲ)也能使
转化为
,
的作用是。
①
②
③
计算热分解反应④
的
。

①越小,
平衡转化率,理由是。
②对应图中曲线,计算其在
之间,
分压的平均变化率为
。
反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是。
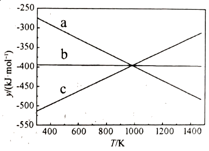
②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比。
A.不变 B.增大 C.减小 D.无法判断
①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。
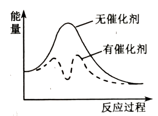
用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:;步骤Ⅱ:。
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH10。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1 , KI=-3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1 , KII=1.2×1048
结合数据说明氯化过程中加碳的理由 。